题目内容
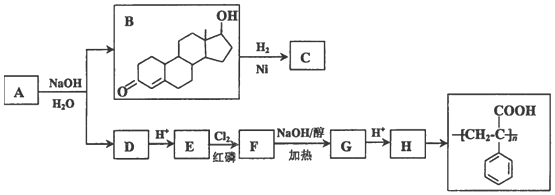
2.钛铁矿(主要成分是FeTiO3,钛酸亚铁)为主要原料冶炼金属钛的工业生产流程如图1所示.
(1)上述生产流程中加入铁屑的目的是将Fe3+还原为Fe2+.
(2)副产品是FeSO4•7H2O.
(3)写出由TiO2+水解生成H2TiO3的离子方程式TiO2++H2O?H2TiO3+2H+.
(4)由TiO2转化为TiCl4的反应方程式是:TiO2(s)+2Cl2(g)+2C(s)$\stackrel{高温}{?}$TiCl4(g)+2CO(g),
TiCl4的百分含量随温度的变化如图2所示,升高温度时,K值减小(填“增大”、“减小”或“不变”)
分析 钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,将Fe3+还原为Fe2+,可防止Fe2+氧化,趁热过滤,滤液中含有FeSO4和TiOSO4,冷却结晶,析出FeSO4•7H2O副产品,得到含有TiOSO4的滤液,加入水,加热可水解生成H2TiO3,过滤得到H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti;
(1)浓硫酸具有强氧化性,与Fe2+反应生成Fe3+,加入铁粉可将Fe3+还原成Fe2+;
(2)滤液中含有FeSO4和TiOSO4,冷却结晶,析出FeSO4•7H2O副产品;
(3)TiO2+水解生成H2TiO3和氢离子;
(4)由图象可知,升高温度TiCl4的百分含量减小,说明升高温度平衡向逆反应方向移动,据此判断.
解答 解:(1)浓硫酸具有强氧化性,与Fe2+反应生成Fe3+,加入铁粉可将Fe3+还原成Fe2+,故答案为:将Fe3+还原为Fe2+;
(2)滤液中含有FeSO4和TiOSO4,冷却结晶,得到FeSO4•7H2O晶体,所以副产品为FeSO4•7H2O,故答案为:FeSO4•7H2O;
(3)TiO2+水解生成H2TiO3和氢离子,水解方程式为TiO2++H2O?H2TiO3+2H+,
故答案为:TiO2++H2O?H2TiO3+2H+;
(4)平衡常数仅与温度有关,由图象可知,升高温度TiCl4的百分含量减小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,
故答案为:减小.
点评 本题考查工艺流程,题目难度中等,本题注意分析流程各反应物的转化,题中考查点较多,学习中注重相关知识、方法的积累.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
12.下列离子方程式中,正确的是( )
| A. | 向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
13.光导纤维已成为信息社会必不可少的高技术材料,用于制造光导纤维的物质是( )
| A. | Si | B. | SiO2 | C. | Na2SiO3 | D. | CaSiO3 |
10.由一种阳离子与两种酸根离子组成的盐称为混盐.混盐CaOCl2在酸性条件下可以产生Cl2,下列关于混盐CaOCl2 的有关判断不正确的是( )
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐具有较强的氧化性 | |
| C. | 该混盐中氯元素的化合价为零 | |
| D. | 该混盐与硫酸反应产生71gCl2时转移1mol 电子 |
17.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 0.5 mol白磷(P4,结构如图)含有2NA个P-P键 | |
| B. | 23g钠与在一定条件下与氧气作用,若两者均无剩余,转移NA个电子 | |
| C. | 1mol/L(NH4)2SO4溶液中,含SO2-4NA个,NH+4少于2NA个 | |
| D. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 |
7.下列说法不正确的是( )
| A. | 一定温度下,某密闭容器发生如下反应:CaCO3(s)?CaO(s)+CO2(g),达到平衡后,将容器体积缩小为原来的一半,当体系再次达到化学平衡时,CO2的物质的量浓度不变 | |
| B. | 已知某温度下,Kw=l×10-13,若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合,保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9 | |
| C. | 已知:KSP(AgCl)=1.8×10-10,Ksp(Ag2CrO2)=2.0×10-12,将0.001 mol•L-1的AgNO3溶液滴入0.001mol•L-1 KCl和0.001 rnol•L-1IK2CrO4的混合溶液中,先产生AgCl沉淀 | |
| D. | 已知25℃时,有关弱酸的电离平衡常数:HCNKa=4.9×10-10:H2CO3,Ka1=4.3×10-7,Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2═2HCN+Na2CO3 |
11.化合物Mg5Al3(OH)x(H2O)4可作环保型阻燃材料,受热时会发生如下分解反应(其中M是某种物质,a为化学计量数):2Mg5Al3(OH)x(H2O)4$\frac{\underline{\;△\;}}{\;}$27H2O↑+10M+aAl2O3
下列说法正确的是( )
下列说法正确的是( )
| A. | a=2 | |
| B. | x=18 | |
| C. | M的化学式为MgO | |
| D. | 该反应中Mg5Al3(OH)x(H2O)4既是氧化剂又是还原剂 |
1. (1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
(1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
已知:CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1K1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1K2
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1K3
(1)则CO2和氢气合成CH3OCH3(g)的热化学方程式为2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5kJ/mol;
该反应的平衡常数K=$\frac{{{K}_{1}}^{2}•{K}_{2}}{{{K}_{3}}^{2}}$(用K1、K2、K3表示)
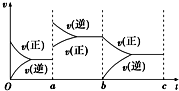
(2)如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a→b过程中改变的条件可能是升高温度;b→c过程中改变的条件可能是将SO3从体系中分离出来.
(3)在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)═M(g)+N(g),所得实验数据如表:
则实验③中达到平衡时X的转化率为60%; 实验④中达到平衡时b<(填“>”“<”或“=”)0.060.
 (1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
(1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.已知:CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1K1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1K2
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1K3
(1)则CO2和氢气合成CH3OCH3(g)的热化学方程式为2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5kJ/mol;
该反应的平衡常数K=$\frac{{{K}_{1}}^{2}•{K}_{2}}{{{K}_{3}}^{2}}$(用K1、K2、K3表示)
(2)如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a→b过程中改变的条件可能是升高温度;b→c过程中改变的条件可能是将SO3从体系中分离出来.
(3)在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)═M(g)+N(g),所得实验数据如表:
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
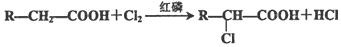
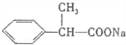 .
. .
. 、
、 .
.