题目内容
16.向100ml 18mol/L硫酸溶液中加入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量是( )| A. | 小于0.9mol | B. | 等于0.9mol | ||
| C. | 在0.45mol与0.9mol之间 | D. | 大于0.9mol |
分析 Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,由方程式可知:被还原的硫酸的物质的量是参加反应的硫酸的一半;但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半.
解答 解:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,由方程式可知:被还原的硫酸的物质的量是参加反应的硫酸的一半;即0.1L×18mol/L×$\frac{1}{2}$=0.9mol;但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于0.9mol,
故选A.
点评 本题考查硫酸的性质,难度不大.要注意铜与浓硫酸在加热条件下能发生反应,铜与稀硫酸不反应.

练习册系列答案
相关题目
4.在1L某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入 19.2g铜粉,微热,充分反应后溶液中c(Cu2+)为( )
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
1.酸雨中存在电离平衡:H2S03?H++HSO${\;}_{3}^{-}$和HSO${\;}_{3}^{-}$?H++S032-,下列说法正确的是( )
| A. | 若向H2SO3,溶液中加入氯化钙溶液,平衡向右移动,会产生亚硫酸钙沉淀. | |
| B. | 若向H2S03溶液巾加人氢氧化钠溶液,平衡向右移动,pH变大 | |
| C. | 适当升溫(假如亚硫酸不分解不挥发),平衡向左移动,电离平衡常数减小 | |
| D. | 25℃时,笫一步电离常数K,小于第二步电离常数K2 |
8. 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
(1)该小组同学向5mLlmol/LFeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(2)向5mLlmol/LFeCl3溶液中通人足量的SO2,在实验时,溶液由棕黄色变成红棕色,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色,能被Fe3+氧化为SO${\;}_{4}^{2-}$.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为缩短红棕色变为浅绿色的时间,进行了如下实验:
向步骤①和步骤②所得溶液中滴加K3[Fe(CN)6](添化学式)试剂,溶液立即出现蓝色沉淀.
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:(1)该小组同学向5mLlmol/LFeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(2)向5mLlmol/LFeCl3溶液中通人足量的SO2,在实验时,溶液由棕黄色变成红棕色,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色,能被Fe3+氧化为SO${\;}_{4}^{2-}$.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为缩短红棕色变为浅绿色的时间,进行了如下实验:
向步骤①和步骤②所得溶液中滴加K3[Fe(CN)6](添化学式)试剂,溶液立即出现蓝色沉淀.
| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
6.醋酸的下列性质中可以证明它是弱电解质的是( )
| A. | 醋酸与水以任意比例互溶 | |
| B. | 10 mL 1 mol•L-1醋酸恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| C. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| D. | 在相同浓度下,醋酸的导电性比一元强酸溶液的弱 |
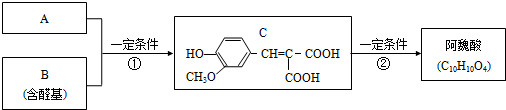
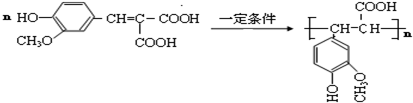 .
.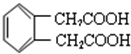 .
. W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;