题目内容
5.归纳法是高中化学学习常用的方法之一,某化学科研小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)①常温下,pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低.
②pH=2的盐酸和pH=1的醋酸,c(H+)之比为2:1.
③已知醋酸电离常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka•Kh=Kw
④反应A(g)?2B(g);△H,若正反应的活化能为EakJ•mol-1,逆反应的活化能为EbkJ•mol-1,则△H=(Ea-Eb)kJ•mol-1.
其归纳正确的是( )
| A. | 全部 | B. | ③④ | C. | ②④ | D. | ①②④ |
分析 ①强酸溶液加水稀释后,溶液中氢离子浓度降低,氢氧根离子浓度增大;
②c(H+)=10-pH;
③酸的电离平衡常数、酸根离子水解平衡常数与水的离子积常数之间的关系为Ka•Kh=Kw;
④反应A(g)?2B(g),若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,反应的焓变等于正逆反应活化能之差.
解答 解:①pH=1的强酸溶液,加水稀释后,溶液中c(H+)减小,温度不变,则水的离子积常数不变,则c(OH-)增大,故错误;
②c(H+)=10-pH,pH=2的盐酸和pH=1的醋酸,c(H+)之比为=0.01mol/L:0.1mol/L=1:10,故错误;
③已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh,水的离子积为Kw,则三者关系为:Ka•Kh=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$×$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=Kw,故正确;
④逆反应的活化能=正反应的活化能+反应的焓变,所以△H=逆反应的活化能-正反应的活化能=(Ea-Eb)kJ•mol-1,故正确;
故选B.
点评 本题考查较综合,涉及弱电解质的电离、盐类水解、焓变等知识点,注意稀释酸或碱中并不是所有粒子都减小,知道酸的电离平衡常数、酸根离子水解平衡常数与离子积常数之间的关系式,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列有关环境问题的说法不正确的是( )
| A. | 燃煤时加入适量石灰石,可减少废气中SO2的含量 | |
| B. | 京津冀、长三角、珠三角雾霾的形成与煤的燃烧、化工厂大量排放含硫、含氮氧化物、颗粒物和汽车排放的尾气等有关 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 使用洁净能源、为汽车安装尾气转化装置、对硝酸厂排放的废气进行碱处理能有效控制氮氧化物对空气的污染 |
16.向100ml 18mol/L硫酸溶液中加入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量是( )
| A. | 小于0.9mol | B. | 等于0.9mol | ||
| C. | 在0.45mol与0.9mol之间 | D. | 大于0.9mol |
13.YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于${\;}_{39}^{89}$Y的说法正确的是( )
| A. | Y在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{89}$Y是两种不同的核素 | |
| D. | 核素${\;}_{39}^{89}$Y的质子数与中子数之差为50 |
20.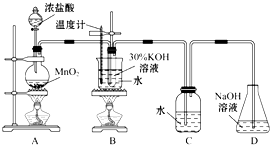 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验.
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)若对调B和C装置的位置,(填“可能”或“不可能”)提高B中氯酸钾的产率可能.
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
①系列a实验的实验目的是研究反应体系中硫酸浓度对反应产物的影响.
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色.
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):量取一定量的试样,加入足量的H2O2溶液,充分反应后,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,过滤,洗净烘干后称量沉淀质量,计算可得.
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-.
 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验.
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)若对调B和C装置的位置,(填“可能”或“不可能”)提高B中氯酸钾的产率可能.
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色.
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):量取一定量的试样,加入足量的H2O2溶液,充分反应后,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,过滤,洗净烘干后称量沉淀质量,计算可得.
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-.
10.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,2.24LH2O中分子的数目为0.1NA | |
| B. | 0.1mol•L-1NH4Cl溶液中含有Cl-的数目为0.1NA | |
| C. | 常温下,1.7gNH3中含有氢原子数目为0.3 NA | |
| D. | 5.6g铁粉在足量的氯气中充分燃烧,转移电子数为0.2NA |
14.①丁烷 ②2-甲基丙烷 ③戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷等物质的沸点按由高到低的排列顺序正确的是( )
| A. | ①>②>③>④>⑤ | B. | ⑤>④>③>②>① | C. | ③>①>④>②>⑤ | D. | ③>④>⑤>①>② |
15.CH3CH2Br与NH3反应生成(CH3CH2)2NH和HBr,下列说法错误的是( )
| A. | 若原料完全反应成上述产物,CH3CH2Br与NH3的物质的量之比为2:1 | |
| B. | CH3CH2Br和HBr均属于电解质 | |
| C. | 该反应属于取代反应 | |
| D. | CH3CH2Br难溶于水 |