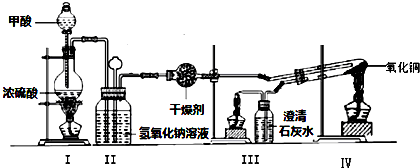
题目内容
14.A、B两种短周期非金属元素组成的化合物甲,能与强碱反应,生成一种含A元素的气体乙和一种含B元素的含氧酸盐丙,乙能使湿润的红色石蕊试纸变蓝,丙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解.(1)A的基态原子核外电子排布式为1s22s22p3.
(2)A、B的电负性由大到小的顺序是(用元素符号表示)N>Si.
(3)乙分子的空间构型是三角锥形,乙能与硫酸铜溶液反应得到的透明溶液,其中的阳离子的配位键和共价键数目之比为1:3.
(4)甲的晶体结构中,A、B原子间以单键相连,且都满足8电子稳定结构,其中B原子杂化轨道类型是sp3,甲与烧碱反应的化学方程式为Si3N4+6NaOH+3H2O=3Na2SiO3+4NH3↑.
分析 化合物甲,能与强碱反应,生成一种含A元素的气体乙和一种含B元素的含氧酸盐丙,乙能使湿润的红色石蕊试纸变蓝,证明乙气体为NH3,说明甲中含有氮元素;含氧酸盐丙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解,说明生成的沉淀为H2SiO3,证明甲中含有硅元素,材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高,证明是一种原子晶体含有氮元素和硅元素,依据元素化合价熟悉得到甲为Si3N4,判断丙为硅酸钠,A为N元素,B为Si元素,以此解答该题.
解答 解:化合物甲,能与强碱反应,生成一种含A元素的气体乙和一种含B元素的含氧酸盐丙,乙能使湿润的红色石蕊试纸变蓝,证明乙气体为NH3,说明甲中含有氮元素;含氧酸盐丙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解,说明生成的沉淀为H2SiO3,证明甲中含有硅元素,材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高,证明是一种原子晶体含有氮元素和硅元素,依据元素化合价熟悉得到甲为Si3N4,判断丙为硅酸钠,A为N元素,B为Si元素,
(1)A为N元素,基态原子核外电子排布式为1s22s22p3,
故答案为:1s22s22p3;
(2)同周期元素从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,电负性N>Si,故答案为:N>Si;
(3)乙为氨气,为三角锥形,氨气中含有1个孤对电子,含有3个N-H键,其中孤对电子形成配位键,则配位键和共价键数目之比为1:3,
故答案为:三角锥形;1:3;
(4)B为Si,与N元素形成4个共价键,为sp3杂化,甲与烧碱反应的化学方程式为Si3N4+6NaOH+3H2O=3Na2SiO3+4NH3↑,
故答案为:sp3;Si3N4+6NaOH+3H2O=3Na2SiO3+4NH3↑.
点评 本题考查原子结构、元素周期率知识,为高考常见题型,侧重于考查物质转化关系和物质性质的分析判断,主要是结构推断,性质和反应现象的理解应用,难度中等.

| 选项 | 相关说法 | 主要原因 |
| A | 包装内放置透气的硅胶包,有利于防止食品变质 | 硅胶有强吸水性 |
| B | 面粉加工车间悬挂有“严禁烟火”的牌子 | 烟火会污染面粉 |
| C | 某些铁制品出厂时在其表面涂上一层油膜可防止其生锈 | 铁被氧化,在其表面形成一层致密的保护膜 |
| D | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | NH3$\stackrel{O_{2}/催化剂}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
| A. | Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将过量SO2气体通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| C. | 用醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
| A. | 去年12月我国向月球发射的“玉兔号”月亮车,体现了我国航天科技的实力,车上安装的太阳能电池帆板的材料是二氧化硅 | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 中国食品质量监督局规定,从2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,由此说明添加剂均会严重危害人体健康 | |
| D. | 以煤为燃料的工厂、汽车尾气排放物等容易造成雾霾,治理雾霾最好的办法是研制纳米级口罩,以确保肺癌的发病率降低 |
| A. | 铜片与浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向漂白精溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | H2C2O4溶液能使KMnO4酸性溶液褪色 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
| A. | 硬铝 | B. | 水银 | C. | 黄金 | D. | 金刚石 |
| A. | 某单核粒子的核外电子排布为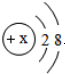 ,则该微粒一定是氖原子 ,则该微粒一定是氖原子 | |
| B. | 原子最外层只有1个电子的元素一定是金属元素 | |
| C. | NH4+与H3O+具有相同的质子数和电子数 | |
| D. | 最外层电子数是次外层电子数2倍的原子容易失去电子成为阳离子 |