题目内容
13.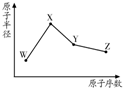 R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.
R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.Ⅰ.(1)Y在周期表中的位置为第三周期IVA族;
(2)R的气态氢化物的电子式为
 ,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);(3)X的单质在空气中燃烧生成一种淡黄色固体,这种化合物中存在的化学键是离子键、共价键;
(4)Z的单质常用于饮用水杀菌消毒,在新制Z单质的水溶液中存在多个含Z元素的平衡关系,请写出任意两个平衡式Cl2+H2O?HCl+HClO、HClO?H++ClO-.
Ⅱ.饮用水中含有一定浓度的RW${\;}_{3}^{-}$将对人类健康产生危害,RW${\;}_{3}^{-}$能氧化人体血红蛋白中的Fe(Ⅱ),使其失去携氧功能.为了降低饮用水中RW${\;}_{3}^{-}$的浓度,某兴趣小组提出了如下方案:
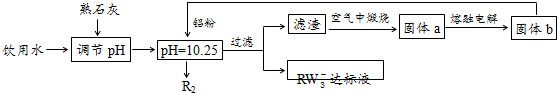
请回答下列问题:
(1)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和RW${\;}_{3}^{-}$反应的离子方程式为10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
(2)该方案中选用熟石灰调节pH,理由是来源丰富、价格便宜;引入的Ca2+对人体无害;若pH过大或过小都会造成Al的利用率降低.
分析 I.R、W、X、Y、Z是⑤种常见的短周期元素,通常R的单质占空气体积的五分之四左右,则R为N元素;W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的非金属性在同周期元素中最强,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素;
Ⅱ.由流程图可知,pH=10.25时,Al和NO3-发生氧化还原反应生成氮气,滤渣中含有Al元素,滤渣在空气中加热得到固体a,电解熔融的a得到固体b,则固体b是Al,a是Al2O3,则滤渣为Al、Al(OH)3混合物,所以铝粉和硝酸根离子在碱性条件下反应生成氮气和Al(OH)3,其反应方程式为10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-.
解答 解:I.R、W、X、Y、Z是⑤种常见的短周期元素,通常R的单质占空气体积的五分之四左右,则R为N元素;W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的非金属性在同周期元素中最强,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素.
(1)Y为Si,在周期表中的位置为:第三周期IVA族,
故答案为:第三周期IVA族;
(2)R的气态氢化物为NH3,电子式为 ,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物为硝酸铵,该化合物的水溶液不呈中性的原因是:NH4++H2O?NH3.H2O+H+,
,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物为硝酸铵,该化合物的水溶液不呈中性的原因是:NH4++H2O?NH3.H2O+H+,
故答案为: ;NH4++H2O?NH3.H2O+H+;
;NH4++H2O?NH3.H2O+H+;
(3)X的单质在空气中燃烧生成一种淡黄色固体为Na2O2,含有离子键、共价键,
故答案为:离子键、共价键;
(4)氯气常用于饮用水杀菌消毒,在新制氯气的水溶液中存在多个含Cl元素的平衡关系,任意两个平衡式为:Cl2+H2O?HCl+HClO、HClO?H++ClO-等,
故答案为:Cl2+H2O?HCl+HClO、HClO?H++ClO-;
Ⅱ.由流程图可知,pH=10.25时,Al和NO3-发生氧化还原反应生成氮气,滤渣中含有Al元素,滤渣在空气中加热得到固体a,电解熔融的a得到固体b,则固体b是Al,a是Al2O3,则滤渣为Al、Al(OH)3混合物,所以铝粉和硝酸根离子在碱性条件下反应生成氮气和Al(OH)3,
(1)反应离子方程式为:10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-,
故答案为:10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
(2)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应,否则会造成Al的大量消耗,
故答案为:来源丰富、价格便宜;引入的Ca2+对人体无害;铝.
点评 本题考查结构性质位置关系应用、化学工艺流程,属于拼合型题目,推断元素是解题关键,注意对元素周期律的理解,侧重学生分析与应用能力的考查.

 阅读快车系列答案
阅读快车系列答案| A. | 2-乙基戊烷 | B. | 3-甲基-2-戊烯 | C. | 2-甲基-3-戊炔 | D. | 1-甲基-5-乙基苯 |
| 选项 | 相关说法 | 主要原因 |
| A | 包装内放置透气的硅胶包,有利于防止食品变质 | 硅胶有强吸水性 |
| B | 面粉加工车间悬挂有“严禁烟火”的牌子 | 烟火会污染面粉 |
| C | 某些铁制品出厂时在其表面涂上一层油膜可防止其生锈 | 铁被氧化,在其表面形成一层致密的保护膜 |
| D | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| A. | A | B. | B | C. | C | D. | D |
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3:非金属氧化物SO2、SO3.
(2)现设计如图所示实验装置(图中铁架台略去),检验绿矾的分解产物.
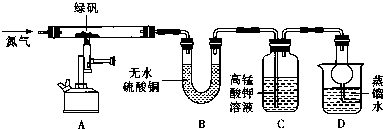
按上述装置进行实验,同学们观察到如下现象:
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左一右),注明药品的名称[可供选择的药品有1mol/L NaOH溶液、0.5mol/L BaCl2溶液、0.5mol/L Ba(NO3)2溶液].
装置示意图现象结论
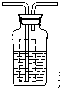 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3(5)根据上述实验,写出绿矾高温分解的化学方程式2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O.
| A. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| C. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO${\;}_{3}^{2-}$═CaCO3↓+SO${\;}_{3}^{2-}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO${\;}_{3}^{-}$═3Ag++NO↑+2H2O |
| A. | H2SO4 | B. | C2H5OH | C. | HNO3 | D. | NaOH |
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | NH3$\stackrel{O_{2}/催化剂}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
| A. | Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将过量SO2气体通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| C. | 用醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
| A. | 硬铝 | B. | 水银 | C. | 黄金 | D. | 金刚石 |