题目内容
13.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如下流程:
下列说法正确的是( )
| A. | 溶解烧渣选用足量酸,可以从常见的强酸中选择任意一种,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,只需要缓慢加热至溶液出现少量晶体,停止加热利用余热蒸干即可 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
分析 硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其它杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,以此进行解答.
解答 解:A.制取七水合硫酸亚铁(FeSO4•7H2O),为不引入新的杂质,溶解烧渣选用足量硫酸,X为铁粉,故A错误;
B.硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其它杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1中一定含有SiO2,调节pH值使铝离子完全生成氢氧化铝沉淀,则固体2为氢氧化铝,故B正确;
C.亚铁离子易被空气中的氧气氧化,所以从溶液2得到FeSO4•7H2O产品的过程中,不能缓慢加热至溶液出现少量晶体,利用余热蒸干,须控制条件防止其氧化和分解,故C错误;
D.在溶液1中含有铁离子和铝离子,加过量的氢氧化钠,铝离子转化为偏铝酸根离子,铁离子与氢氧根离子结合生成氢氧化铁沉淀,所以最终得到的是硫酸铁而不是硫酸亚铁,故D错误.
故选B.
点评 本题考查制备实验方案的设计与评价、工艺流程的分析应用,题目难度中等,侧重学生分析能力和创新能力的培养,注意把握常见物质的分离方法.

练习册系列答案
相关题目
1.氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2 (g)=4NO (g)+6H2O (L)△H1
②4NH3(g)+6NO(g)=5N2 (g)+6H2O (L)△H2
则反应 4NH3(g)+3O2(g)=2N2 (g)+6H2O (L)△H=$\frac{3△{H}_{1}+2△{H}_{2}}{5}$(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol N2 在一定条件下合成氮,平衡时仅改变温度测得的数据如下表所示:
已知:破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量.
①则 T1、<T2(填“>”、“<”或“=”)
②T2K下,经过10min达到化学平衡状态,则o~10min内H2的平均速率v(H2)=0.1mol•L-1•min-1.
③下列图象分别代表焓变(△H),混合气体平均相对分子质量($\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态是BC.

(3)电化学降解治理水中硝酸盐污染,在酸性条件下,电化学降解NO3-的原理如图1,阴极反应式为2NO3-+12H++10e-=N2↑+6H2O.

(4)通过控制溶液的pH对工业废水中的金属离子进行分离.图2是某些金属氢氧化物在不同浓度和pH的沉淀--溶解图象,图中直线上的点表示平衡状态.当溶液中的离子浓度小于1×10-5mol•L-1时,认为该离子沉淀完全.
由图可知Cu(OH)2的浓度积的值为1×10-21.8.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2 (g)=4NO (g)+6H2O (L)△H1
②4NH3(g)+6NO(g)=5N2 (g)+6H2O (L)△H2
则反应 4NH3(g)+3O2(g)=2N2 (g)+6H2O (L)△H=$\frac{3△{H}_{1}+2△{H}_{2}}{5}$(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol N2 在一定条件下合成氮,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则 T1、<T2(填“>”、“<”或“=”)
②T2K下,经过10min达到化学平衡状态,则o~10min内H2的平均速率v(H2)=0.1mol•L-1•min-1.
③下列图象分别代表焓变(△H),混合气体平均相对分子质量($\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态是BC.

(3)电化学降解治理水中硝酸盐污染,在酸性条件下,电化学降解NO3-的原理如图1,阴极反应式为2NO3-+12H++10e-=N2↑+6H2O.

(4)通过控制溶液的pH对工业废水中的金属离子进行分离.图2是某些金属氢氧化物在不同浓度和pH的沉淀--溶解图象,图中直线上的点表示平衡状态.当溶液中的离子浓度小于1×10-5mol•L-1时,认为该离子沉淀完全.
由图可知Cu(OH)2的浓度积的值为1×10-21.8.
8.下列关于天然物质水解的叙述正确的是( )
| A. | 乙酸乙酯的水解反应在碱性条件下比在酸性条件下水解更容易 | |
| B. | 油脂的水解可得到甘油,称为皂化反应 | |
| C. | 蛋白质水解的最终产物均为葡萄糖 | |
| D. | 淀粉水解和纤维素水解得到的最终产物相同,它们是同分异构体 |
18.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物只有一种 |

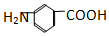 和
和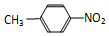 C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl
C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl