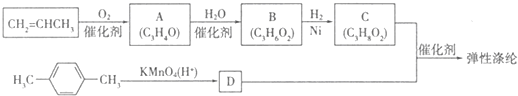
题目内容
下列表达方式正确的是( )
A、基态碳原子的价电子排布图: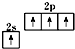 |
| B、HClO的结构式:H-Cl-O |
| C、基态26Fe的价电子排布式:3d64s2 |
D、基态铜原子的价电子排布图: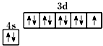 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:A、C的原子序数为6,价电子排布为2s22p2;
B、HClO的中心原子为O,结构式为H-O-Cl;
C、Fe的原子序数为26,电子排布为[Ar]3d64s2;
D、Cu的原子序数为29,价电子排布为3d104s1.
B、HClO的中心原子为O,结构式为H-O-Cl;
C、Fe的原子序数为26,电子排布为[Ar]3d64s2;
D、Cu的原子序数为29,价电子排布为3d104s1.
解答:
解:A、C的原子序数为6,价电子排布为2s22p2,基态碳原子的价电子排布图为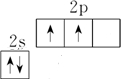 ,故A错误;
,故A错误;
B、HClO的中心原子为O,结构式为H-O-Cl,故B错误;
C、Fe的原子序数为26,电子排布为[Ar]3d64s2,因此基态26Fe的价电子排布式:3d64s2,故C正确;
D、Cu的原子序数为29,价电子排布为3d104s1,基态铜原子的价电子排布图为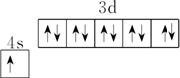 ,故D错误;
,故D错误;
故选C.
 ,故A错误;
,故A错误;B、HClO的中心原子为O,结构式为H-O-Cl,故B错误;
C、Fe的原子序数为26,电子排布为[Ar]3d64s2,因此基态26Fe的价电子排布式:3d64s2,故C正确;
D、Cu的原子序数为29,价电子排布为3d104s1,基态铜原子的价电子排布图为
 ,故D错误;
,故D错误;故选C.
点评:本题考查原子核外电子排布,明确原子序数及价电子排布是解答本题的关键,注意电子排布规律及全满、半满为稳定结构,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列依据相关实验得出的结论正确的是( )
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有CO32- |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定含有Na+ |
| C、向某溶液中滴加BaCl2溶液产生白色沉淀,再滴加稀HNO3沉淀不溶解,则原溶液中一定含有SO42- |
| D、向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
下列各基态原子或离子的电子排布式正确的是( )
| A、O2- 1s22s22p4 |
| B、Ca[Ar]3d2 |
| C、Si 1s22s22p63s23p2 |
| D、Zn[Ar]3d104s1 |
下列说法中正确的是( )
| A、s电子绕核旋转,其轨道为一圆圈,而p电子是∞字形 |
| B、能层为1时,有自旋相反的两个轨道 |
| C、能层为3时,有3s、3p、3d、4f四个轨道 |
| D、s电子云是球形对称的,其疏密程度表示电子在该处出现的几率大小 |
不能确定为磷元素的化学用语是( )
| A、3s23p3 |
| B、(n+1)sn(n+1)pn+1 |
C、 |
D、 |
下列说法中不正确的是( )
| A、处于最低能量的原子叫做基态原子 |
| B、4f 4表示4f能级有四个轨道 |
| C、同一原子中,2p、3d、4f能级的轨道数依次增多 |
| D、同一原子中,2p、3p、4p电子的能量逐渐增大 |