题目内容
下列各基态原子或离子的电子排布式正确的是( )
| A、O2- 1s22s22p4 |
| B、Ca[Ar]3d2 |
| C、Si 1s22s22p63s23p2 |
| D、Zn[Ar]3d104s1 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:A.O2-离子核外电子数为8+2=10;
B.违背能量最低原理,Ca原子核外电子排布式为:[Ar]4s2;
C.Si原子核外电子数为14,核外电子排布式为1s22s22p63s23p2;
D.Zn的原子序数为30,处于ds区,原子核外有30个电子,其电子排布式为[Ar]3d104s2.
B.违背能量最低原理,Ca原子核外电子排布式为:[Ar]4s2;
C.Si原子核外电子数为14,核外电子排布式为1s22s22p63s23p2;
D.Zn的原子序数为30,处于ds区,原子核外有30个电子,其电子排布式为[Ar]3d104s2.
解答:
解:A.O2-离子核外电子数为10,电子排布式是1s22s22p6,故A错误;
B.违背能量最低原理,Ca原子核外电子排布式为:[Ar]4s2,故B错误;
C.Si原子核外电子数为14,核外电子排布式为1s22s22p63s23p2,故C正确;
D.Zn的原子序数为30,处于ds区,原子核外有30个电子,其电子排布式为[Ar]3d104s2,故D错误,
故选C.
B.违背能量最低原理,Ca原子核外电子排布式为:[Ar]4s2,故B错误;
C.Si原子核外电子数为14,核外电子排布式为1s22s22p63s23p2,故C正确;
D.Zn的原子序数为30,处于ds区,原子核外有30个电子,其电子排布式为[Ar]3d104s2,故D错误,
故选C.
点评:本题考查了基态原子的核外电子排布式,根据核外电子排布规律来写,注意电子处于全满、半满、全空时最稳定,题目难度不大.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、24 g镁的原子最外层电子数为NA |
| B、1 L 0.1 mol?L-1硫酸溶液中H+数为0.1NA |
| C、1 mol甲烷分子所含质子数为10NA |
| D、标准状况下,22.4 L乙醇的分子数为NA |
原子序数为26的Fe核外未成对的电子数为( )
| A、5 | B、4 | C、3 | D、2 |
下列表达方式正确的是( )
A、基态碳原子的价电子排布图: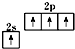 |
| B、HClO的结构式:H-Cl-O |
| C、基态26Fe的价电子排布式:3d64s2 |
D、基态铜原子的价电子排布图: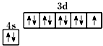 |
下列说法正确的是( )
| A、可用碘水鉴别苯、四氯化碳、乙醇三种无色液体 |
| B、取0.2mol NaCl固体于烧杯中,加入200 mL蒸馏水充分搅拌可配成1mol/L的NaCl溶液 |
| C、测定溶液的酸碱性时,应先将pH试纸润湿,然后进行检测 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等 |


 (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子. →B的反应类型是
→B的反应类型是
 互为同系物的是
互为同系物的是