题目内容
4.将一定量的铁粉加入到装有100mL某浓度的稀硝酸溶液中充分反应.(1)溶液中剩有a g铁粉,收集到NO气体448mL(标准状况下),求:
①写出所得溶液中溶质成分;
②求硝酸的物质的量浓度.
(2)向上述固液混合物中逐渐滴加稀硫酸,又有气体产生,若该气体为纯净物,遇到空气变为红棕色,且此时容器中剩余铁粉b g(b>0),
求:①(a-b)最大值;
②当(a-b)取最大值时,确定此时溶液中溶质成分.
分析 (1)①容器中剩有m g的铁粉,生成硝酸亚铁;
②硝酸完全反应生成硝酸亚铁与NO,根据n=$\frac{V}{{V}_{m}}$计算NO的物质的量,根据电子转移守恒计算参加反应的n(Fe),由氮元素守恒可知:n(HNO3)=2n[Fe(NO3)2]+n(NO),再根据c=$\frac{n}{V}$计算;
(2)①a-b的值为加入硫酸后再溶解的金属铁的质量,根据反应方程式中铁和硝酸根离子量的关系计算即可;
②混合物中逐滴加入稀硫酸,Fe先和HNO3(氢离子由硫酸提供)生成NO,然后是Fe和H2SO4反应生成H2,据此确定溶液中的溶质.
解答 解:(1)①容器中剩有m g的铁粉,所得溶液中的溶质为Fe(NO3)2,
答:所得溶液中溶质成分为Fe(NO3)2;
②硝酸完全反应生成硝酸亚铁与NO,NO的物质的量=$\frac{0.448L}{22.4L/mol}$=0.02mol,根据电子转移守恒,参加反应的n(Fe)=$\frac{0.02mol×3}{2}$=0.03mol,由氮元素守恒可知:n(HNO3)=2n[Fe(NO3)2]+n(NO)=2×0.03mol+0.02mol=0.08mol,故原硝酸的物质的量浓度=$\frac{0.08mol}{0.1L}$=0.8mol/L,
答:硝酸的物质的量浓度为0.8mol•L-1;
(2)①Fe先和HNO3(氢离子由硫酸提供)生成NO,关系为:3Fe~2NO3-,溶液中硝酸根离子的物质的量是0.08mol-0.02mol=0.06mol,所以消耗铁的物质的量是$\frac{0.06mol×3}{2}$=0.09mol,质量是0.09mol×56g/mol=5.04 g,即(a-b)最大值为5.04,
答:(a-b)最大值为5.04;
②向上述固-液混合物中逐滴加入稀硫酸溶液中的反应顺序为:Fe先和HNO3(氢离子由硫酸提供)生成NO,因为此时铁还是有剩余,所以硝酸根离子被消耗光,硝酸根反应完全后,再是Fe和H2SO4反应生成H2,此时溶液中的溶质为硫酸亚铁,
答:此时溶液中溶质成分FeSO4.
点评 本题考查化学方程式的计算、氧化还原反应计算,侧重对解题方法技巧与学生分析解决问题能力的考查,注意根据守恒进行解答,难度较大.

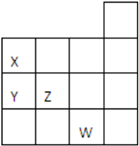 如图所示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述不正确的是( )
如图所示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述不正确的是( )①Y的最高价氧化物对应的水化物化学式为HYO3
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,可与铁粉反应生成FeBr2
④W的原子序数比Z大9.
| A. | 只有④ | B. | ①③④ | C. | ②③ | D. | ①②④ |
| A. |  稀硫酸 | B. |  CuSO4溶液 | C. |  酒精溶液 | D. |  稀硫酸 |
| A. | 固体氯化铵和消石灰混合加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| B. | 硫化亚铁与盐酸反应:S2-+2H+═H2S↑ | |
| C. | 铜与稀硝酸:Cu+4H++2NO3-═Cu2++NO2↑+2H2O | |
| D. | 向氨水中通入过量的二氧化碳:NH3•H2O+CO2═NH4++HCO3- |
| A. | FeO | B. | Fe | C. | Fe(OH)3 | D. | Fe2O3 |
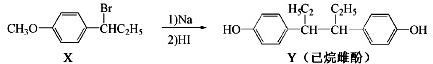
| A. | 在一定条件,化合物 Y 可与 HCHO 发生缩聚反应 | |
| B. | 用 FeCl3溶液不能鉴别化合物 X 和 Y | |
| C. | 在 NaOH 水溶液中加热,化合物 X 可发生消去反应 | |
| D. | 化合物 Y 中不含有手性碳原子 |