题目内容
16.某校化学实验室由于保管不慎,存放的亚硫酸钠试剂可能己部分被氧化变质,现通过实验来测定某无水亚硫酸钠试剂是否变质及其纯度.实验步骤如下:①称量a g样品,置于烧杯中;②加入适量蒸馏水,使样品溶解;③加入稀盐酸,使溶液呈强酸性,再加入过量的BaCl2溶液;④过滤,用蒸馏水洗涤沉淀;⑤加热干燥沉淀物;⑥将沉淀物冷却至室温后,称量;⑦重复⑤、⑥操作直到合格,最后得到b g固体.回答下列问题:
(1)亚硫酸钠变质的反应方程式为2Na2SO3+O2=2Na2SO4.
(2)上述可以得出亚硫酸钠样品己经变质这一结论的具体现象是:溶解后加入盐酸使溶液呈强酸性除去亚硫酸钠后,加入过量氯化钡溶液生成白色沉淀证明变质.
(3)步骤③中加过量的BaCl2溶液,判断过量的方法是:加入过量的BaCl2溶液振荡静置,取上层清液加入硫酸钠溶液若出现白色沉淀证明氯化钡过量.
(4)步骤④中判断沉淀洗净的方法是:取最后一次的洗涤液,加入AgNO3溶液观察是否有白色沉淀生成,如果产生白色沉淀,说明还未洗净;如果无白色沉淀,则说明已洗干净;.
(5)根据实验数据,样品中Na2SO3的质量分数为$\frac{233a-142b}{233a}$×100%.
分析 测定亚硫酸钠的纯度,先称量出样品质量,然后将样品溶于水中加酸酸化除去溶液中的亚硫酸根离子,再加入氯化钡使溶液中硫酸根离子生成硫酸钡沉淀,最后利用硫酸钡的质量计算出硫酸钠的耳机物质的量和质量,从而测定出亚硫酸钠的纯度;
(1)亚硫酸钠被空气中氧气氧化生成硫酸钠;
(2)用盐酸酸化可以将SO32-转化为SO2除去,再加入过量的BaCl2溶液生成白色沉淀证明亚硫酸钠变质;
(3)步骤③中加过量的BaCl2溶液,判断过量的方法是加入过量的BaCl2溶液振荡静置,取上层清液加入硫酸钠溶液若出现白色沉淀证明氯化钡过量;
(4)步骤④中判断沉淀洗净是检验洗涤液中是否含氯离子设计实验检验;
(5)沉淀质量为W2g为硫酸钡的质量,计算出硫酸钡的物质的量,从而知道硫酸钠的物质的量,再根据样品的质量计算出样品中亚硫酸钠的纯度.
解答 解:(1)亚硫酸钠变质的反应方程式为:2Na2SO3+O2=2Na2SO4,故答案为:2Na2SO3+O2=2Na2SO4;
(2)亚硫酸钠变质是被空气中氧气氧化为硫酸钠,样品加入适量蒸馏水,使样品溶解,加入稀盐酸,使溶液呈强酸性,再加入过量的BaCl2溶液生成白色沉淀证明亚硫酸钠变质,
故答案为:溶解后加入盐酸使溶液呈强酸性除去亚硫酸钠后,加入过量氯化钡溶液生成白色沉淀证明变质;
(3)步骤③中加过量的BaCl2溶液,硫酸根离子全部沉淀,判断氯化钡溶液过量的方法是:加入过量的BaCl2溶液振荡静置,取上层清液加入硫酸钠溶液若出现白色沉淀证明氯化钡过量,
故答案为:加入过量的BaCl2溶液振荡静置,取上层清液加入硫酸钠溶液若出现白色沉淀证明氯化钡过量;
(4)若沉淀没有洗涤干净,在洗涤液中会含有氯离子,所以检验沉淀已洗涤干净的方法为:取最后一次的洗涤液,加入AgNO3溶液观察是否有白色沉淀生成,如果产生白色沉淀,说明还未洗净;如果无白色沉淀,则说明已洗干净,
故答案为:取最后一次的洗涤液,加入AgNO3溶液观察是否有白色沉淀生成,如果产生白色沉淀,说明还未洗净;如果无白色沉淀,则说明已洗干净;
(5)硫酸钡沉淀质量为bg,硫酸钡的物质的量为:n(BaSO4)=n(Na2SO4)=$\frac{bg}{233g/mol}$=$\frac{b}{233}$mol,样品中亚硫酸钠的纯度为:ω(Na2SO3)=$\frac{ag-\frac{b}{233}mol×142g/mol}{ag}$×100%=$\frac{233a-142b}{233a}$×100%,
故答案为:$\frac{233a-142b}{233a}$×100%.
点评 本题考查了亚硫酸纯度的测定方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

 阅读快车系列答案
阅读快车系列答案| A. | 属于第二周期第VIA族元素 | B. | 原子最外层电子数为8 | ||
| C. | 质子数为16 | D. | 与167N互为同位素 |
| A. | FeCl3 | B. | 溴水 | C. | 石蕊试液 | D. | KMnO4溶液 |
( )
| A. | $\frac{{{ρ_1}+{ρ_2}}}{2}$ | B. | $\frac{30.0%+20.0%}{2}$ | C. | 小于25.0% | D. | 大于25.0% |
| A. | 硅燃烧产物对环境产生的污染,容易得到有效控制 | |
| B. | 硅燃烧可以放出较多的热量 | |
| C. | 自然界中硅的贮存量丰富,可以从自然界直接获得单质硅 | |
| D. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一 |
| A. | NaHCO3溶液中加入稀 HCl:CO23-+2H+═H2O+CO2↑ | |
| B. | 将 NaHSO4与 Ba(OH)2溶液混合至中性:2H++SO24-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 苯酚钠溶液中通入少量 CO2气体:2C6H5O-+CO2+H2O→2C6H5OH+CO23- | |
| D. | 用惰性电极电解氯化铝溶液:2Cl-+2H2O═Cl2↑+H2↑+2OH- |
 Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
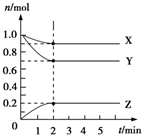
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)CH3 | C. | C(CH3)4 | D. | CH3CH(CH3)CH2CH3 |