题目内容
15.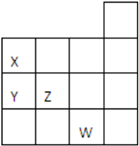 如图所示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述不正确的是( )
如图所示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述不正确的是( )①Y的最高价氧化物对应的水化物化学式为HYO3
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,可与铁粉反应生成FeBr2
④W的原子序数比Z大9.
| A. | 只有④ | B. | ①③④ | C. | ②③ | D. | ①②④ |
分析 根据X、Y、Z、W在元素周期表中的相对位置可知,X为N元素、Y为P元素、Z为S元素、W为Br元素,然后结合元素周期律知识对各选项进行判断.
解答 解:根据元素周期表结构可知,X为N元素、Y为P元素、Z为S元素、W为Br元素,
①Y为P,其最高价氧化物对应的水化物为磷酸,化学式为H3PO4,故①错误;
②Y、Z的非金属性:Z大于Y,非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性Y<Z,故②正确;
③W为Br,其单质为溴,溴单质常温下呈液态,与铁粉反应生成的是FeBr3,故③错误;
④W为Br,原子序数为35,Z为S,原子序数为16,W的原子序数比Z大35-16=19,故④错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容、元素周期表结构为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.关于168O,说法正确的是( )
| A. | 属于第二周期第VIA族元素 | B. | 原子最外层电子数为8 | ||
| C. | 质子数为16 | D. | 与167N互为同位素 |
3. 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:
请回答下列问题:
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3.
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$ cm3(写出表达式即可).
 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层 上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3.
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$ cm3(写出表达式即可).
10.下列有关物质性质的比较,不正确的是( )
| A. | 金属性:Li>Na>K>Rb | B. | 酸性:HF<HCl<HBr<HI | ||
| C. | 微粒半径:K+>Na+>Mg2+>Al3+ | D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
20.下列物质中,能与醋酸发生反应的是( )
①石蕊 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙.
①石蕊 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙.
| A. | ①③④⑤⑥⑦ | B. | ②③④⑤ | C. | ①②④⑤⑥ | D. | 全部 |
7.用一种试剂能鉴别苯酚、戊烯、己烷、乙醇四种溶液,这种试剂是( )
| A. | FeCl3 | B. | 溴水 | C. | 石蕊试液 | D. | KMnO4溶液 |
5. Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明温度对反应速率有影响,该因素对反应速率的具体影响是:其它条件相同时,温度越高反应速率越快.
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
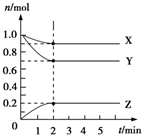
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
 Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).