题目内容
4.计算下列粒子数目(1)9g H2O中原子总数为1.5mol,质子总数为5mol.
(2)含0.4mol Al3+的Al2(SO4)3固体中SO42-的数目为0.6mol.
分析 (1)9g H2O的物质的量为:$\frac{9g}{18g/mol}$=0.5mol,而1mol水中含有原子数为3mol,1mol水中质子总数为10mol,由此分析解答;
(2)根据物质的构成特点判断,由化学式可知,Al2(SO4)3中n(Al3+):n(SO42-)=2:3,以此解答该题.
解答 解:(1)9g H2O的物质的量为:$\frac{9g}{18g/mol}$=0.5mol,而1mol水中含有原子数为3mol,所以9g H2O中原子总数为1.5mol,1mol水中质子总数为10mol,所以9g H2O中质子总数为5mol,故答案为:1.5mol;5mol;
(2)Al2(SO4)3中n(Al3+):n(SO42-)=2:3,n(Al3+)=0.4mol,则n(SO42-)=0.6mol,故答案为:0.6mol.
点评 本题考查物质的量的有关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,题目难度不大,但易错,注意把握物质的构成特点.

练习册系列答案
相关题目
14.下列递变规律正确的是( )
| A. | HClO4、H3PO4、H2SO4的酸性依次减弱 | |
| B. | HCl、HBr、HI的稳定性依次减弱 | |
| C. | N、O、F原子半径逐渐增大 | |
| D. | 钠、镁、铝的还原性依次减弱 |
12.如图有关于化学反应速率和化学平衡的四个图象,下列反应中全部符合上述图象的反应是( )
| A. | 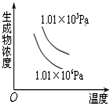 4NH3(g)+5O2(g)?4NO+6H2O(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 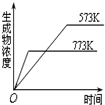 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. |  N2(g)+3H2(g)?2NH3(g);△H=-Q3kJ/mol(Q3>0) | |
| D. | 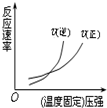 H2(g)+CO(g)?C(s)+H2O(g);△H=+Q4kJ/mol(Q4>0) |
6.关于168O,说法正确的是( )
| A. | 属于第二周期第VIA族元素 | B. | 原子最外层电子数为8 | ||
| C. | 质子数为16 | D. | 与167N互为同位素 |
3. 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:
请回答下列问题:
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3.
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$ cm3(写出表达式即可).
 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层 上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3.
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$ cm3(写出表达式即可).
 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应. ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.