题目内容
8.进行一氯取代后,只生成三种沸点不同的产物的烷烃是( )| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CCH2CH3 |
分析 某烷烃发生氯代反应后,只能生成三种沸点不同的一氯代产物,则说明该有机物的一氯代物有3种;根据等效氢原子来判断各烷烃中氢原子的种类,有几种类型的氢原子就有几种一氯代物,据此进行解答.
解答 解:A.(CH3)2CHCH2CH2CH3中有5种位置不同的氢,所以其一氯代物有5种,能生成5种沸点不同的产物,故A错误;
B.(CH3CH2)2CHCH3中有4种位置不同的氢,所以其一氯代物有4种,能生成4种沸点不同的产物,故B错误;
C.(CH3)2CHCH(CH3)2含有2种位置不同的氢,所以其一氯代物有2种,能生成2种沸点不同的有机物,故C错误;
D.(CH3)3CCH2CH3中有3种位置不同的氢,所以其一氯代物有3种,能生成3种沸点不同的产物,故D正确.
故选D.
点评 本题考查同分异构体的判断,注意有几种类型的氢原子就有几种一氯代物,题目难度不大.

练习册系列答案
相关题目
18.下列离子方程式正确的是( )
| A. | 铁与盐酸的反应:2Fe+6H +═2Fe 3 ++3 H 2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO 3+2H +═Ca 2 ++2H 2O+CO 2↑ | |
| C. | 铜片插入硝酸银溶液:Cu+Ag +═Cu 2++Ag | |
| D. | 钠与水反应::2Na+2H 2O═2OH -+2Na ++H 2↑ |
16.短周期主族元素a、b、c、d的原子序数依次增大,a原子的最外层电子数是其质子数的$\frac{2}{3}$,b原子的核电荷数等于d原子的最外层电子数,元素c的最高正化合价为+2价,下列说法正确的是( )
| A. | 简单离子的半径:d>c | |
| B. | 单质的沸点:a<b | |
| C. | b、d的氧化物对应的水化物均为强酸 | |
| D. | b、c可形成离子化合物b3c2 |
3.金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期,ⅢA族,化学性质与铝元素相似.
(1)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成,反应中,生成3mol H2时放出30.8KJ的热.
①反应的热化学方程式是2Ga(s)+2NH3(g)?2GaN(s)+3H2(g)△H=-30.8KJ/mol.
②反应的化学平衡常数表达式是$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;温度升高时,反应的平衡常数变小.(填“变大”“变小”或“不变”)
③在密闭体系内进行上述可逆反应,下列有关表达正确的是A.

A.图象Ⅰ中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.图象Ⅱ中纵坐标可以为镓的转化率
C.图象Ⅲ中纵坐标可以为化学反应速率
D.图象Ⅳ中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是GaN+OH-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$GaO2-+NH3↑.
(2)将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3.
(3)工业上电解精炼镓的原理如下:待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,高纯度镓为阴极,NaOH溶液为电解质溶液.在电流作用下使粗镓在阳极溶解进入电解质溶液,离子迁移到达阴极并在阴极放出电析出高纯镓.
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解精炼镓时阳极泥的成分是Fe、Cu.
②GaO2-在阴极放电的电极方程式是GaO2-+3e-+2H2O=Ga+4OH-.
(1)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成,反应中,生成3mol H2时放出30.8KJ的热.
①反应的热化学方程式是2Ga(s)+2NH3(g)?2GaN(s)+3H2(g)△H=-30.8KJ/mol.
②反应的化学平衡常数表达式是$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;温度升高时,反应的平衡常数变小.(填“变大”“变小”或“不变”)
③在密闭体系内进行上述可逆反应,下列有关表达正确的是A.

A.图象Ⅰ中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.图象Ⅱ中纵坐标可以为镓的转化率
C.图象Ⅲ中纵坐标可以为化学反应速率
D.图象Ⅳ中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是GaN+OH-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$GaO2-+NH3↑.
(2)将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-2 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
(3)工业上电解精炼镓的原理如下:待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,高纯度镓为阴极,NaOH溶液为电解质溶液.在电流作用下使粗镓在阳极溶解进入电解质溶液,离子迁移到达阴极并在阴极放出电析出高纯镓.
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解精炼镓时阳极泥的成分是Fe、Cu.
②GaO2-在阴极放电的电极方程式是GaO2-+3e-+2H2O=Ga+4OH-.
13.依据下列事实所得出的结论或推测正确的是( )
| 事实 | 结论或推测 | |
| A | Na与冷水激烈反应,生成H2 | Mg与沸水迅速反应,生成H2 |
| B | F2与H2暗处剧烈化合,生成的HF很稳定 | I2与H2加热也能化合,生成的HI也很稳定 |
| C | Na与O2加热反应生成Na2O2 | IA元素单质与O2加热反应均生成过氧化物 |
| D | H3PO4是中强酸,As是P的同主族非金属元素 | H3AsO4是强酸 |
| A. | A | B. | B | C. | C | D. | D |
16.下列实验操作正确的是( )
| A. | 取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好 |
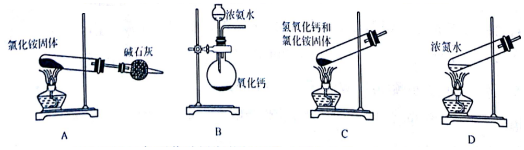
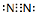 .下列能实现人工固氮的是D.
.下列能实现人工固氮的是D.