题目内容
16.短周期主族元素a、b、c、d的原子序数依次增大,a原子的最外层电子数是其质子数的$\frac{2}{3}$,b原子的核电荷数等于d原子的最外层电子数,元素c的最高正化合价为+2价,下列说法正确的是( )| A. | 简单离子的半径:d>c | |
| B. | 单质的沸点:a<b | |
| C. | b、d的氧化物对应的水化物均为强酸 | |
| D. | b、c可形成离子化合物b3c2 |
分析 a原子的最外层电子数是其质子数的$\frac{2}{3}$,应为C元素,元素c的最高正化合价为+2价,应为Mg元素,b原子的核电荷数等于d原子的最外层电子数,则b的核电荷数大于6,小于8,应为7,则b为N元素,d为Cl元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知a为C、b为N、c为Mg、d为Cl元素.
A.氯离子核外有3个电子层,镁离子核外有2个电子层,电子层数越多,离子半径越大,则简单离子的半径:d>c,故A正确;
B.a为C,对应的单质中,金刚石、石墨都为原子晶体,沸点较高,故B错误;
C.d为Cl元素,如为HClO,则为弱酸,故C错误;
D.b、c可形成离子化合物c3b2,故D错误.
故选A.
点评 本题考查原子结构与元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握原子结构特点,明确元素的种类为解答该题的关键,难度不大.

练习册系列答案
相关题目
4.取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A. | 3.6mol/L | B. | 3.2mol/L | C. | 2.8mol/L | D. | 2.4mol/L |
11.下列说法正确的是( )
| A. | 电解精炼铜时,粗铜与外接电源的负极相连 | |
| B. | 纯水中c(H+)=5×10-7mol•L-1,则c(OH-)=2×10-8mol•L-1 | |
| C. | CH3COONH4溶液显中性,说明CH3COONH4中的离子均不发生水解 | |
| D. | 向pH和体积均相同的盐酸和醋酸中各加入少量相同质量的锌粉,后者反应速率最大 |
1.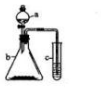 利用右下图所示的装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测c中现象正确的是( )
利用右下图所示的装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测c中现象正确的是( )
 利用右下图所示的装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测c中现象正确的是( )
利用右下图所示的装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测c中现象正确的是( )| 选项 | a | b | c | c试管中的现象 |
| A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
| B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
| C | 饱和NaCl | CaC2 | 硫酸铜溶液 | 产生蓝色沉淀 |
| D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
8.进行一氯取代后,只生成三种沸点不同的产物的烷烃是( )
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CCH2CH3 |
5.某药物中间体的合成路线如下:下列说法正确的是( )
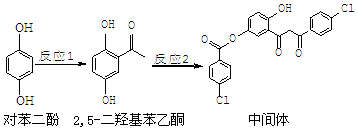

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有羰基和烃基两种含氧官能团 |
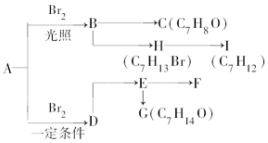 A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体:
A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体: ,
, .
.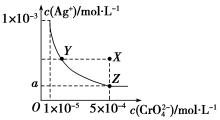 图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.
图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.