题目内容
15.已知在常用催化剂(如铂、钯)的催化下,氢气和炔烃加成生成烷烃,难于得到烯烃,但使用活性较低的林德拉催化剂[Pd/(PbO、CaCO3),其中钯附着于碳酸钙及少量氧化铅上],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化.现有一课外活动兴趣小组利用上述原理设计了一套由如图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制得乙烯,并测定乙炔氢化的转化率.若用含0.020molCaC2的电石和1.60g含杂质18.7%的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水VmL.试回答有关问题:
(1)装置的连接顺序是a、e、d、f、g、b、c、h(填各接口的字母).
(2)写出A中所发生反应的化学方程式(有机物写结构简式):CaC2+2H2O→HC≡CH↑+Ca(OH)2.
(3)D的作用是除去杂质气体.
(4)为减慢A中的反应速率,X应选用饱和食盐水.
(5)F中留下的气体除含C2H4、少许空气外,还有H2、C2H4、C2H2.G所选用的量筒的容积较合理的是B.(标准状况下)
A.500mL B.1000mL C.2000mL
(6)乙炔氢化的转化率为(用V来表示)$\frac{896-V}{448}$×100%.
分析 (1)根据实验的目的是用乙炔和氢气之间的反应来制取乙烯,根据装置的特点和应用来连接实验装置;
(2)碳化钙可以和水反应得到乙炔气体,乙炔气体和氢气在催化剂的作用下反应得到乙烯;
(3)乙炔在制取的过程中,还会含有杂质气体,要进行除杂,并进行干燥;
(4)为减慢反应速率,可以将水换成饱和食盐水,利用活塞控制流速;
(5)根据CaC2+2H2O→HC≡CH↑+Ca(OH)2结合实验实际情况来确定存在的杂质气体及体积;
(6)根据反应:CaC2+2H2O→HC≡CH↑+Ca(OH)2、HC≡CH+H2$\frac{\underline{\;林德拉\;}}{\;}$CH2=CH2结合乙炔氢化的转化率等于反应的乙炔和全部的乙炔的量的比值来计算.
解答 解:(1)实验装置显示制取乙炔和氢气,然后将二者混合,但是乙炔、氢气中含有杂质气体,应该先将杂质气体除去,再将之干燥,是纯净的气体在催化剂的作用下发生反应得到乙烯,乙烯是难溶于水的气体,可以采用排水法收集,所以装置的连接顺序是:a、e、d、f、g、b、c、h(f、g可调换),
故答案为:edfgbc(或edgfbc可调换);
(2)A中是碳化钙和水反应制取乙炔的过程,方程式为:CaC2+2H2O→HC≡CH↑+Ca(OH)2,
故答案为:CaC2+2H2O→HC≡CH↑+Ca(OH)2;
(3)为了保证得到的气体纯净,应该将气体进行除杂,次氯酸钠具有碱性和氧化性,可以除去杂质,故答案为:除去杂质气体;
(4)碳化钙和水之间的反应十分剧烈,为减慢反应速率,可以将水换成饱和食盐水,操作时还应采取的措施是通过调节分液漏斗活塞降低食盐水的滴速,
故答案为:饱和食盐水;
(5)F中留下的气体除含少许空气外,还有没有完全消耗的乙炔,氢气以及生成的乙烯等气体,CaC2+2H2O→HC≡CH↑+Ca(OH)2中,若乙炔完全反应生成0.02molHC≡CH,其体积为0.02mol×22.4L/mol=0.896L=896mL,G所选用的量筒的容积较合理的是B,
故答案为:H2、C2H4、C2H2;B;
(6)0.020molCaC2的电石,和水反应得到乙炔的物质的量是0.02mol,1.60g含杂质18.7%的锌粒(杂质不与酸反应)的物质的量是:$\frac{1.6×(1-18.7%)}{65}$mol=0.02mol,和硫酸反应,产生的氢气的物质的量是0.005mol,状况下测得G中收集到的水VmL,则得到的乙烯的物质的量是$\frac{V×1{0}^{-3}L}{22.4L/mol}$
设乙炔的转化量是x,则
HC≡CH+H2 $\frac{\underline{\;林德拉\;}}{\;}$CH2=CH2
0.02 0.02 0
x x x
则反应后得到气体的物质的量(0.02-x)+(0.02-x)+x=$\frac{V×1{0}^{-3}L}{22.4L/mol}$,
解得x=(0.04-$\frac{V×1{0}^{-3}}{22.4}$)mol,
所以乙炔氢化的转化率为$\frac{(0.04-\frac{V×1{0}^{-3}}{22.4})mol}{0.02mol}$×100%=$\frac{896-V}{448}$×100%,
故答案为:$\frac{896-V}{448}$×100%.
点评 本题考查性质实验及含量测定,为高频考点,把握物质的性质、实验装置的作用及发生的反应等为解答的关键,侧重分析与实验、计算能力的考查,题目难度中等.

| A. | 石墨与金刚石 | B. | 1735Cl和1737Cl | C. | CO和CO2 | D. | 1H2、2D2和3T2 |
| A. | 原子总数 | B. | 质子总数 | C. | 电子总数 | D. | 质量 |
| A. | 氟化氢的电子式: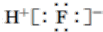 | B. | 中子数为21的钾原子:${\;}_{19}^{40}$K | ||
| C. | NH3的结构式: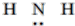 | D. | N3-的结构示意图: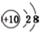 |
 ;
;

 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
.