题目内容
3.(1)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图1所示装置.试回答下列问题: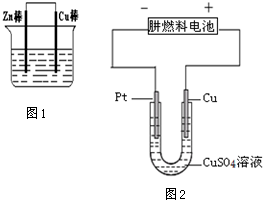
①若电解质溶液为稀硫酸,则Zn棒为原电池的负极,可观察到Cu棒的所产生现象是有气体析出,试用电极反应式表示该现象:2H++2e-=H2↑.
②若电解质为硫酸铜溶液,则Cu棒上发生还原反应,Zn棒上发生反应的电极反应式为:Zn-2e-=Zn2+.
③若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为:1:32.
(2)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.如图2是一个电化学过程示意图.
①铂片上发生的电极反应是Cu2++2e-═Cu.
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼-空气燃料电池理论上消耗标准状况下的空气112L(假设空气中氧气体积含量为20%).
分析 (1)①铜锌原电池中,活泼金属作负极,在正极上有气体生成;
②若电解质为硫酸铜溶液,则在正极上析出铜;
③根据原电池两极上得失电子数目相等计算;
(2)电解硫酸铜溶液,阴极上铜离子放电,阳极上铜失电子发生氧化反应;根据串联电路中转移电子相等计算.
解答 解:(1)①将Zn棒和Cu棒用导线连接后,若电解质溶液为稀硫酸,则锌为负极,铜为正极,负极反应为:Zn-2e-=Zn2+,正极反应为:2H++2e-=H2↑,在正极上有气体生成,
故答案为:负;有气体析出;2H++2e-=H2↑;
②将Zn棒和Cu棒用导线连接后,若电解质为硫酸铜溶液,则在正极上析出铜,锌为负极,负极反应为Zn-2e-=Zn2+,正极反应为:Cu2++2e-=Cu,
故答案为:还原;Zn-2e-=Zn2+;
③设上述两个过程中都消耗1molZn,则:Cu棒上(1)所析出物质的质量为:1mol×2g/mol=2g,(2)所析出物质的质量为:1mol×64g/mol=64g,Cu棒上(1)和(2)所析出物质的质量之比为2g:64g=1:32,故答案为:1:32;
(2)①电解硫酸铜溶液,阴极铂上铜离子放电生成铜单质,电极反应式为Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
②阳极上铜失电子发生氧化反应,消耗128g铜转移电子的物质的量=$\frac{128g}{64g/mol}$×2=4mol,
根据串联电路中转移电子相等得消耗标准状况下的氧气体积=$\frac{4mol}{4}$×22.4L/mol=22.4L,
氧气的体积占空气的20%,
所以空气体积=22.4÷20%=112L,
故答案为:112.
点评 本题以联氨为背景考查了原电池及电解池,据电解原理的电极反应特点写出铂极上的电极反应式,并结合质量变化进行相关计算,根据已知化学电源的书写方法,难度不大.

| A. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| B. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| C. | Na2O2可用作呼吸面具中的供氧剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
| A. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | BrCl+H2O═HCl+HBrO | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
 在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )| A. | 6:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
| A. | M的氢化物的水溶液呈酸性 | B. | M2在常温常压下一定是气体 | ||
| C. | MO3-中的M元素只能被还原 | D. | M位于元素周期表的第VA族 |
 .
.