题目内容
8.以下金属的冶炼(“→”前为原料,“→”后为所得的金属),其中最适宜用热还原法冶炼的是( )①MgCl2→Mg;②MnO2→Mn;③ZnO→Zn;④HgO→Hg;⑤磁铁矿→Fe;⑥KCl→K.
| A. | ①②④ | B. | ②③⑤ | C. | ②③⑤⑥ | D. | ①②③⑤ |
分析 金属的冶炼一般有电解法、热还原法、热分解法、物理分离法,金属活动顺序表中的金属冶炼:活泼金属K、Ca、Na、Mg、Al一般用电解熔融的氯化物(AI是电解熔融的三氧化二铝)制得;较不活泼的金属Zn、Fe、Sn、Pb、Cu等用热还原法制得,常用还原剂有(C、CO、H2等);Hg、Ag用加热分解氧化物的方法制得,Pt、Au用物理分离的方法制得,以此来解答.
解答 解:①MgCl2→Mg、⑥KCl→K利用电解法冶炼;
②MnO2→Mn、③ZnO→Zn、⑤磁铁矿→Fe均可利用热还原法冶炼;
④HgO→Hg利用加热分解法,
故选B.
点评 本题考查金属的冶炼,为高频考点,把握金属活泼性及金属冶炼原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 是酚酞变红色的溶液:K+、Fe3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3- |
3.铁元素是重要的金属元素,铁单质及化合物在工业和生活中也有广泛的用途.
(1)在实验室中,FeCl2可用铁粉和盐酸反应制备,FeCl3可用铁粉和氯气反应制备.
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应制取K2FeO4,其反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.与MnO2-Zn电池类似,K2FeO4-Zn也可组成碱性电池,该电池的总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(3)铁与水反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<0上述反应的平衡常数表达式K=$\frac{[{H}_{2}]{\;}^{4}}{[{H}_{2}O]^{4}}$.
(4)若在2L恒容绝热(不与外界交换能量)装置中,按下表充入起始物质,起始时与平衡后的物质的物质的量见下表:
达平衡后,若再加入四种物质,各物质的物质的量如下表:
当重新达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是B>C>A(用A、B、C表示).
(5)已知常温下:Fe(OH)3的Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12,若将MgCl2、FeCl3均为0.1mol•L-1混合溶液中的pH用MgO调节至pH=4,则溶液中$\frac{c(M{g}^{2+})}{c(F{e}^{3+})}$比值约为108.
(1)在实验室中,FeCl2可用铁粉和盐酸反应制备,FeCl3可用铁粉和氯气反应制备.
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应制取K2FeO4,其反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.与MnO2-Zn电池类似,K2FeO4-Zn也可组成碱性电池,该电池的总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(3)铁与水反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<0上述反应的平衡常数表达式K=$\frac{[{H}_{2}]{\;}^{4}}{[{H}_{2}O]^{4}}$.
(4)若在2L恒容绝热(不与外界交换能量)装置中,按下表充入起始物质,起始时与平衡后的物质的物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下:Fe(OH)3的Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12,若将MgCl2、FeCl3均为0.1mol•L-1混合溶液中的pH用MgO调节至pH=4,则溶液中$\frac{c(M{g}^{2+})}{c(F{e}^{3+})}$比值约为108.
6.t℃时,AgCl 的 Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲 线如图所示.下列说法正确的是( )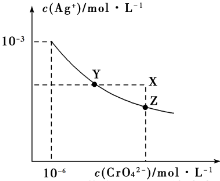

| A. | 在 t℃时,AgCl 的溶解度大于 Ag2CrO4 | |
| B. | 在 t℃时,Ag2CrO4的 Ksp=1×10-1210-3 | |
| C. | 在饱和 Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X 点 | |
| D. | 在 t℃时,用 AgNO3 标准溶液滴定 20mL 未知浓度的 KCl 溶液,不能采用K2CrO4溶液为指示剂 |
3.某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)

反应原理:

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
(1)仪器A的名称是分液漏斗.
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:混酸未冷却加入三颈瓶(或水浴温度过高)导致反应温度过高而产生大量副产物或冷凝效果不佳导致浓硝酸、甲苯等反应物挥发而降低一硝基甲苯产率.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合液$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物\stackrel{操作2}{→}\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无机混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).

反应原理:

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:混酸未冷却加入三颈瓶(或水浴温度过高)导致反应温度过高而产生大量副产物或冷凝效果不佳导致浓硝酸、甲苯等反应物挥发而降低一硝基甲苯产率.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合液$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物\stackrel{操作2}{→}\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无机混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
4.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |

 ),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为
),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为 .
.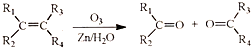 (R1、R2、R3、R4为烃基或氢原子)
(R1、R2、R3、R4为烃基或氢原子)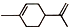 )发生上述反应的产物中分子量较大的结构简式
)发生上述反应的产物中分子量较大的结构简式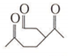 .
.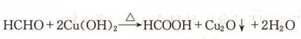 .
.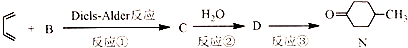
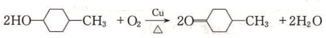 .
. 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题: