题目内容
20.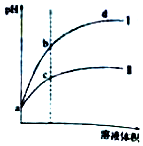 某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | 曲线Ⅱ对应氯化铵溶液 | |
| B. | 与等浓度的NaOH溶液恰好反应时曲线Ⅰ对应的溶液消耗NaOH溶液体积大 | |
| C. | b点比c点水的电离程度大 | |
| D. | c、d两点的离子积常数不等 |
分析 HCl为强酸,完全电离,而氯化铵水解显酸性,等pH稀释相同倍数时,HCl的pH变化大,则图中I为盐酸,II为氯化铵溶液,氯化铵的浓度大于盐酸的浓度,且盐酸抑制水的电离,氯化铵促进水的电离,Kw只与温度有关,以此来解答.
解答 解:A.等pH稀释相同倍数时,HCl的pH变化大,氯化铵溶液的pH变化小,则图中II为氯化铵溶液,故A正确;
B.等pH时氯化铵的浓度大于盐酸的浓度,则与等浓度的NaOH溶液恰好反应时曲线Ⅰ对应的溶液消耗NaOH溶液体积小,故B错误;
C.b点盐酸溶液中,抑制水的电离,电离程度小,而c点在氯化铵溶液中,促进水的电离,水的电离程度较大,b点比c点水的电离程度小,故C错误;
D.c、d两点温度相同,则离子积常数相等,故D错误;
故选A.
点评 本题考查酸碱混合及盐类水解,为高频考点,把握图中pH的变化判断曲线与溶质的对应关系为解答的关键,侧重分析与应用能力的考查,注意酸碱混合的计算与浓度有关,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
10.下列各项中正确的是( )
| A. | 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯 | |
| B. | 淀粉与纤维素不互为同分异构体,但二者完全水解的产物相同 | |
| C. | 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程 | |
| D. | 对苯二甲酸( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚醋纤维( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚醋纤维( ) ) |
11.下列实验方案能达到实验目的是( )
| 选项 | 目的 | 实验方案 |
| A. | 比较Mg、Al的金属性 | 将去除氧化膜的镁条、铝片分别放入沸水中 |
| B. | 鉴别MgCl2和 AlCl3溶液 | 将过量稀氨水分别滴入MgCl2和 AlCl3溶液中 |
| C. | 证明苯环对羟基活性的影响 | 分别向苯和苯酚溶液中滴加饱和溴水 |
| D. | 比较浓度对反应速率的影响 | 将不同浓度的KMnO4溶液、稀H2SO4与同浓度的H2C2O4溶液混合 |
| A. | A | B. | B | C. | C | D. | D |
5.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法正确的是( )
| A. | 18O 存在于水中 | |
| B. | 18O 存在于乙酸乙酯和乙醇中 | |
| C. | 18O 存在于乙酸乙酯和水中 | |
| D. | 生成的乙酸乙酯的相对分子质量为88 |
12.暴露在空气中质量会变轻的物质是( )
| A. | 氢氧化钠 | B. | 食盐 | C. | 浓硫酸 | D. | 浓盐酸 |
9.如图是研究铁被海水腐蚀的实验装置.图2中M是某种与铁片紧贴的金属,下列说法正确的是( )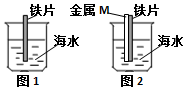

| A. | 图1铁片靠近烧杯底部的部分,腐蚀更严重 | |
| B. | 若M是锌片,可保护铁 | |
| C. | 若M是铜片,可保护铁 | |
| D. | M是铜或是锌都不能保护铁,是因没有构成原电池 |
 磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1
磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1
 .
. .
.