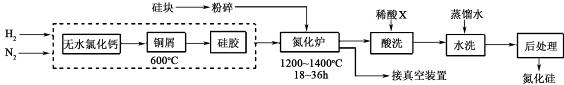
题目内容
2. X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族
(2)上述元素的最高价氧化物对应的水化物酸性最强的酸是HClO4(写化学式)
(3)X2M的燃烧热△H=-a kJ•mol-1,写出X2M燃烧反应的热化学方程式:H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(l)△H=-a kJ•mol-1.
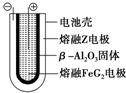
(4)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如图),反应原理为:2Z+FeG2
 Fe+2ZG
Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe;充电时,钠(写物质名称)电极接电源的负极;该电池的电解质为β-Al2O3.
分析 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于O原子序数,所以Z是Na元素;G的原子序数最大,所以G是Cl元素(不考虑稀有气体),据此解答.
解答 解:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于O原子序数,所以Z是Na元素;G的原子序数最大,所以G是Cl元素(不考虑稀有气体).
(1)Y为O元素,在元素周期表中的位置为:第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的酸是:HClO4,
故答案为:HClO4;
(3)H2S的燃烧热△H=-a kJ•mol-1,表示1mol硫化氢气体燃烧生成二氧化碳气体与液态水放出的热量为akJ,H2S燃烧反应的热化学方程式:H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(l)△H=-a kJ•mol-1,
故答案为:H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(l)△H=-a kJ•mol-1;
(4)(熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2 Fe+2NaCl,放电时为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe;充电时为电解池,负极发生还原反应,故Na电极接电源的负极,由电池结构可知,该电池的电解质为β-Al2O3,
Fe+2NaCl,放电时为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe;充电时为电解池,负极发生还原反应,故Na电极接电源的负极,由电池结构可知,该电池的电解质为β-Al2O3,
故答案为:Fe2++2e-=Fe;钠;β-Al2O3.
点评 本题考查结构性质位置关系应用,涉及热化学方程式、元素周期律、原电池、电解池、元素化合物推断等,推断元素是解题关键,注意对基础知识的理解掌握,难度中等.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | Na2CO3固体 | B. | 水 | C. | 硫酸钾固体 | D. | NaOH固体 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 砷的外围电子排布式:3d104S24p3 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: | |
| D. | 过氧化钠的电子式: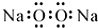 |
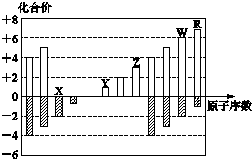
| A. | 离子半径:Z>Y>X | |
| B. | 最高正价氧化物对应的水化物的酸性:R<W | |
| C. | 氢化物的还原性:R>W | |
| D. | R的单质能与W的氢化物反应,可证明非金属性:R>W |
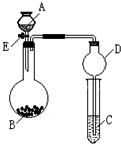 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: