题目内容
10.安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,(1)请写出基态Cu原子的外围电子排布式3d104s1.
焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了跃迁而变为激发态.
(2)新型农药松脂酸铜具有低残留的特点,图1是松脂酸铜的结构简式
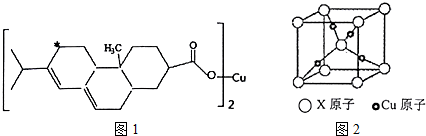
请分析1个松脂酸铜中π键的个数6;加“*”碳原子的杂化方式为sp3.
(3)图2是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号)Cu2X;与X等距离且最近的X原子个数为8.
(4)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型V形,比较第一电离能:S<O(填“>”或“<”)
分析 (1)Cu原子核外电子数为29,根据能量最低原理书写外围电子排布式;基态铜原子在灼烧时外围电子获得能量,发生跃迁而变为激发态,焰色反应为绿色;
(2)单键为σ键,双键含有1个σ键、1个π键;加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4;
(3)根据均摊法计算晶胞中Cu原子、X原子数目,进而确定化学式;体心X原子与晶胞顶点的X原子距离最近;
(4)计算S原子孤对电子、价层电子对数确定其空间结构,同主族自上而下第一电离能减小.
解答 解:(1)Cu原子核外电子数为29,根据能量最低原理,外围电子排布式为:3d104s1,基态铜原子在灼烧时外围电子获得能量,发生跃迁而变为激发态,焰色反应为绿色,
故答案为:3d104s1;跃迁;
(2)1个松脂酸铜中含有个双键,则含有6个π键,加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4,采取sp3杂化,
故答案为:6;sp3;
(3)晶胞中Cu原子数目为4,X原子数目为1+8×$\frac{1}{8}$=2,故化学式为Cu2X,体心X原子与晶胞顶点的X原子距离为晶胞棱长的$\frac{\sqrt{3}}{2}$倍,而位于面心对角线X原子之间距离为棱长的$\sqrt{2}$倍,故体心X原子与晶胞顶点的X原子距离最近,X原子配位数为8,
故答案为:Cu2X;8;
(4)S原子孤对电子数为$\frac{6-2×2}{2}$=1、价层电子对数=2+1=3,故其空间结构为V形,同主族自上而下第一电离能减小,则第一电离能S<O,
故答案为:V形;<.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、晶胞计算、电离能等,难度不大,掌握利用均摊法进行晶胞计算,注意同周期第一电离能异常情况.

练习册系列答案
相关题目
20.下列有关有机物的说法正确的是( )
| A. | 1mol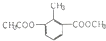 能与4molNaOH充分反应 能与4molNaOH充分反应 | |
| B. |  系统命名法为3-丁烯 系统命名法为3-丁烯 | |
| C. |  的碳原子都在一个平面内,且它的二氯代物为3种 的碳原子都在一个平面内,且它的二氯代物为3种 | |
| D. | 1mol 可以与4molH2发生加成 可以与4molH2发生加成 |
1.某课外实验小组的同学们采取的下列实验操作中,正确的是( )
①甲同学用手取氯化钠;
②乙同学用灯帽盖灭酒精灯;
③丙同学给容量为30mL的试管中加入20mL液体加热;
④丁同学用酒精萃取碘水中的碘;
⑤戊同学将浓硫酸倒入装有适量水的量筒中稀释;
⑥己同学配制NaOH溶液时,将NaOH固体在烧杯中溶解后,立即注入容量瓶中.
①甲同学用手取氯化钠;
②乙同学用灯帽盖灭酒精灯;
③丙同学给容量为30mL的试管中加入20mL液体加热;
④丁同学用酒精萃取碘水中的碘;
⑤戊同学将浓硫酸倒入装有适量水的量筒中稀释;
⑥己同学配制NaOH溶液时,将NaOH固体在烧杯中溶解后,立即注入容量瓶中.
| A. | 只有②③ | B. | 只有② | C. | 只有②③④ | D. | 全部正确 |
18.X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时最外层的电子排布可能是( )
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p2 Y:2s22p4 | ||
| C. | X:3s23p1 Y:3s23p4 | D. | X:3s2 Y:2s22p3 |
19.已知1molX2完全燃烧生成X2O放出热量a kJ.且氧气中1molO=O键完全断裂时吸收热量b kJ,X2O中1molX-O键形成时放出热量c kJ,X2中1molX-X键断裂时吸收热量为( )
| A. | 4c-b+2a kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
12.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2mol/L的Na2CO3溶液中Na+个数为4NA | |
| B. | 2L 0.5mol/LCH3COOH溶液中含有的H+数为NA | |
| C. | 含2mol溶质的浓硫酸与足量的Cu反应转移的电子数为2NA | |
| D. | 1L 2mol/L的K2CO3溶液中CO32-个数小于2NA |
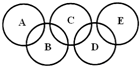 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: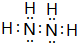 .
. X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. Fe+2ZG
Fe+2ZG