题目内容
7.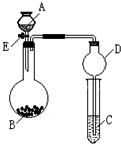 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:(1)若A为水,B为过氧化钠,C中盛有酸化过的FeCl2溶液,旋开活塞E后,烧瓶中发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,C中的现象为溶液由浅绿色逐渐变为(棕)黄色.
(2)利用上述装置可以设计证明氧化性:KMnO4>Cl2>Br2,则A为浓盐酸,B为高锰酸钾,C中是试剂为NaBr.
(3)也可设计证明酸性的强弱:H2SO4>H2CO3>H2SiO3,若C中装的是硅酸钠溶液,则小试管中发生的化学反应方程式为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(4)利用上述装置可以验证SO2的性质,若A为浓硫酸,B为亚硫酸钠固体,C中盛有酸性高锰酸钾溶液,可以验证SO2的还原性.
分析 (1)A为水,B为过氧化钠,C中盛有酸化过的FeCl2溶液,则烧瓶中过氧化钠与水反应生成氧气,氧气可氧化亚铁离子;
(2)设计证明氧化性:KMnO4>Cl2>Br2,则烧瓶中高锰酸钾与浓盐酸反应生成氯气,C中发生氯气与NaBr的氧化还原反应;
(3)计证明酸性的强弱:H2SO4>H2CO3>H2SiO3,则烧瓶中发生硫酸与碳酸钠的反应,C中发生二氧化碳与硅酸钠的反应;
(4)验证SO2的性质,若A为浓硫酸,B为亚硫酸钠固体,C中盛有酸性高锰酸钾溶液,烧瓶中浓硫酸与亚硫酸钠反应生成二氧化硫,C中发生二氧化硫与高锰酸钾的氧化还原反应,以此来解答.
解答 解:(1)A为水,B为过氧化钠,C中盛有酸化过的FeCl2溶液,则烧瓶中过氧化钠与水反应生成氧气,反应为2Na2O2+2H2O=4NaOH+O2↑,氧气可氧化亚铁离子,C中现象为溶液由浅绿色逐渐变为(棕)黄色,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;溶液由浅绿色逐渐变为(棕)黄色;
(2)设计证明氧化性:KMnO4>Cl2>Br2,则烧瓶中高锰酸钾与浓盐酸反应生成氯气,C中发生氯气与NaBr的氧化还原反应,则C中试剂为NaBr,
故答案为:NaBr;
(3)计证明酸性的强弱:H2SO4>H2CO3>H2SiO3,则烧瓶中发生硫酸与碳酸钠的反应,C中发生二氧化碳与硅酸钠的反应,小试管中反应为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,故答案为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
(4)验证SO2的性质,若A为浓硫酸,B为亚硫酸钠固体,C中盛有酸性高锰酸钾溶液,烧瓶中浓硫酸与亚硫酸钠反应生成二氧化硫,C中发生二氧化硫与高锰酸钾的氧化还原反应,S元素的化合价升高,可验证二氧化硫的还原性,故答案为:还原.
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、反应原理、实验装置的作用为解答的关键,侧重分析与实验能力考查,注意实验技能及实验原理分析,题目难度不大.

| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p2 Y:2s22p4 | ||
| C. | X:3s23p1 Y:3s23p4 | D. | X:3s2 Y:2s22p3 |
| A. | 第一次剩余4.8g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0mol•L-1 | |
| C. | 原混合物中铜和铁各0.075mol | |
| D. | 再加入上述100mL稀硝酸,又得到标准状况下1.12LNO |
| A. | 4c-b+2a kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
| 选项 | 离子组 | 分析 |
| A | Na+、Cu2+、SO42-、Cl- | 能大量共存于同一溶液中,通入过量NH3最终产生蓝色沉淀 |
| B | NH4+、Al3+、S2-、Cl- | 不能大量共存于同一溶液中,因为有Al2S3沉淀产生 |
| C | H+、Fe2+、SO42-、Cl- | 能大量共存于同一溶液中,加入KNO3固体后溶液颜色发生变化 |
| D | Na+、K+、HCO3-、OH- | 不能大量共存于同一溶液中,因为HCO3-与OH-反应有CO2生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. Fe+2ZG
Fe+2ZG