题目内容
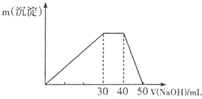
2.怎样用一种试剂区分KCl、CuCl2、FeCl2、FeCl3、MgCl2、AlCl3溶液?简述操作步骤.分析 阴离子相同,阳离子不同,结合与碱反应生成不同颜色的沉淀来鉴别,以此来解答.
解答 解:因阴离子相同,阳离子不同,则选择NaOH溶液检验区分KCl、CuCl2、FeCl2、FeCl3、MgCl2、AlCl3六种溶液,分别取少量滴加NaOH溶液反应的现象:无现象、蓝色沉淀、先生成白色沉淀后迅速变为灰绿色最后为红褐色、红褐色沉淀、白色沉淀、先生成白色沉淀后溶解,现象不同可鉴别,
即操作步骤为分别取少量滴加NaOH溶液反应,无现象的原溶液为KCl、生成蓝色沉淀的为CuCl2、先生成白色沉淀后迅速变为灰绿色最后为红褐色的为FeCl2、生成红褐色沉淀的为FeCl3、生成白色沉淀的为MgCl2、先生成白色沉淀后溶解的为AlCl3,
答:分别取少量滴加NaOH溶液反应,无现象的原溶液为KCl、生成蓝色沉淀的为CuCl2、先生成白色沉淀后迅速变为灰绿色最后为红褐色的为FeCl2、生成红褐色沉淀的为FeCl3、生成白色沉淀的为MgCl2、先生成白色沉淀后溶解的为AlCl3.
点评 本题考查物质的鉴别和检验,为高考常见题型和高频考点,侧重于学生的分析能力的考查,把握发生的反应及现象为解答该题的关键,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
12.在化学实验时必须注意安全操作,避免意外伤害,下列实验操作或事故处理中不正确的是( )
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌 | |
| C. | 浓酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸稀溶液 | |
| D. | 不得点燃添满酒精的酒精灯 |
10.已知25℃、101kPa下,石墨,CO(g)燃烧的热化学方程式分别为:
C(石墨,s)+O2(g)═CO2(g)△H1=-akJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-bkJ•mol-1
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H3=-ckJ•mol-1
则a、b、c的关系正确的是( )
C(石墨,s)+O2(g)═CO2(g)△H1=-akJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-bkJ•mol-1
C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H3=-ckJ•mol-1
则a、b、c的关系正确的是( )
| A. | a=b+c | B. | a=b-c | C. | a=c-b | D. | c=a+b |
7.下列电子式书写正确的是( )
| A. | Ca2+[:$\underset{\stackrel{••}{Cl}}{••}$:]2- | B. | Na+[$\stackrel{•}{X}$$\underset{\stackrel{••}{S}}{••}$$\stackrel{•}{X}$]-2Na+ | ||
| C. | [Mg2+][$\underset{X}{•}$$\underset{\stackrel{••}{O}}{••}$$\underset{X}{•}$]2- | D. | K+[$\stackrel{•}{X}$$\underset{\stackrel{••}{F}}{••}$:]- |
4.已知3mol碳在2mol氧气中燃烧,至反应物耗尽,测得放出热量akJ,又知0.1mol碳完全燃烧,放出热量为bkJ.则化学方程式C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=Q中Q等于( )
| A. | -(a-b)kJ•mol-1 | B. | -(a+b)kJ•mol-1 | ||
| C. | -(5a-0.5b)kJ•mol-1 | D. | -(0.5a-5b)kJ•mol-1 |
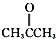 ③CH3CH2Br ④
③CH3CH2Br ④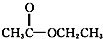 ⑤
⑤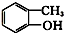
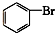 ⑦
⑦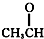 ⑧
⑧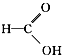 ⑨
⑨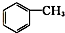 ⑩
⑩
 ;含有的化学键类型有离子键和共价键.
;含有的化学键类型有离子键和共价键.