题目内容
5.固体粉末X中可能含有K2SO3、K2CO3、FeO、Fe2O3、MnO2、Na2SO4中的若干种,为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图: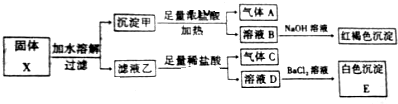
根据上述实验,下列说法中正确的是( )
| A. | 固体X中一定含有Fe2O3 | B. | 沉淀E可能含有BaSO3 | ||
| C. | 气体A、C一定均为纯净物 | D. | 固体X可能出现含有K2SO3、K2CO3 |
分析 由红褐色沉淀可知B中一定含铁离子,结合固体加水,可知沉淀甲中含FeO、Fe2O3中至少一种,FeO、Fe2O3均与盐酸反应不生成气体,则沉淀甲一定含MnO2,MnO2与浓盐酸加热反应生成气体A为Cl2,K2SO3、K2CO3、Na2SO4均溶于水,与盐酸反应后在与氯化钡反应生成白色沉淀,则E为BaSO4,气体C为CO2或SO2,即X中含K2SO3、K2CO3中的至少一种,以此来解答.
解答 解:由红褐色沉淀可知B中一定含铁离子,结合固体加水,可知沉淀甲中含FeO、Fe2O3中至少一种,FeO、Fe2O3均与盐酸反应不生成气体,则沉淀甲一定含MnO2,MnO2与浓盐酸加热反应生成气体A为Cl2,K2SO3、K2CO3、Na2SO4均溶于水,与盐酸反应后在与氯化钡反应生成白色沉淀,则E为BaSO4,气体C为CO2或SO2,即X中含K2SO3、K2CO3中的至少一种,
A.若X中含FeO,与盐酸反应后被氧气氧化,B中含铁离子,与NaOH反应生成红褐色沉淀,则X中不一定含有Fe2O3,故A错误;
B.乙与足量盐酸反应后,D中不含亚硫酸根离子,则沉淀E为BaSO4,故B错误;
C.MnO2与浓盐酸加热反应生成气体A为Cl2,而C可能为二氧化碳、二氧化硫的混合物,故C错误;
D.由上述分析可知,固体X可能出现含有K2SO3、K2CO3,故D正确;
故选D.
点评 本题考查无机物的推断,为高频考点,把握实验流程中发生的反应、现象推断物质为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
20.某元素Y的核外电子数等于核内中子数,取2.8g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则该元素在周期表中位置( )
| A. | 第三周期 | B. | 第一周期 | C. | 第ⅤA族 | D. | 第ⅥA族 |
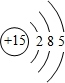

 .
.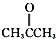 ③CH3CH2Br ④
③CH3CH2Br ④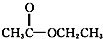 ⑤
⑤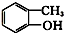
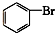 ⑦
⑦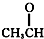 ⑧
⑧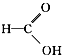 ⑨
⑨ ⑩
⑩
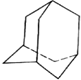 某些石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
某些石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示: