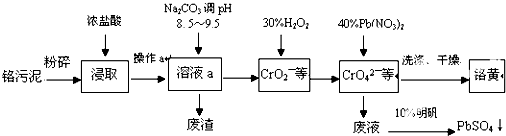
题目内容
向盛有100g水的A、B、C、D四个烧杯中分别加入等物质的量的Na、Na2O、Na2O2、NaOH固体,固体全部溶解得澄清溶液,则各烧杯溶液中溶质的质量分数的顺序为( )
| A、D>C>B>A |
| B、B>C>A>D |
| C、B=C>A>D |
| D、B=C>D>A |
考点:化学方程式的有关计算
专题:
分析:先根据钠原子守恒计算溶质的质量,再根据反应方程式计算溶液的质量,从而计算溶液的质量分数,涉及到的化学方程式有Na+H2O=NaOH+
H2↑,Na2O+H2O=2NaOH,Na2O2+H2O=2NaOH+
O2↑.
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+
H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+
O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g
将氢氧化钠加入水中,溶液增加的质量为氢氧化钠的质量=0.1mol×40g/mol=4g;
所以溶液增加的质量大小顺序为:钠<氢氧化钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,0.1mol,
通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于100g水所得溶液的质量分数分别为:
×100%、
×100%、
×100%、
×100%所以A、B、C、D的质量分数大小的顺序是:D<A<B=C.
故选C.
Na+H2O=NaOH+
| 1 |
| 2 |
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+
| 1 |
| 2 |
将氢氧化钠加入水中,溶液增加的质量为氢氧化钠的质量=0.1mol×40g/mol=4g;
所以溶液增加的质量大小顺序为:钠<氢氧化钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,0.1mol,
通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于100g水所得溶液的质量分数分别为:
| 4g |
| 100g+2.2g |
| 8g |
| 100g+6.2g |
| 8g |
| 100g+6.2g |
| 4g |
| 100g+4g |
故选C.
点评:本题以钠及其化合物的性质考查了溶液质量分数大小的比较,难度较大,明确溶液质量增加的量是解本题的关键.

练习册系列答案
相关题目
有些电影、电视剧中的仙境美轮美奂,这些神话仙境中所需的烟雾是在放于温热石棉网上的NH4NO3和Zn粉的混合物中滴几滴水后产生的白烟:NH4NO3+Zn=ZnO+N2↑+2H2O,下列有关说法中正确的是( )
| A、该反应中NH4NO3只作氧化剂 |
| B、ZnO是还原产物 |
| C、水在反应中可能起催化作用 |
| D、每生成1mol N2共转移8mol电子 |
将钠投入下列溶液中,反应的剧烈程度由强到弱的是( )
①NaCl溶液
②NaOH溶液
③0.1mol?L-1盐酸
④0.1mol?L-1FeCl2溶液
⑤C2H5OH.
①NaCl溶液
②NaOH溶液
③0.1mol?L-1盐酸
④0.1mol?L-1FeCl2溶液
⑤C2H5OH.
| A、①②③④⑤ |
| B、④③①②⑤ |
| C、③④①②⑤ |
| D、⑤①③④② |
下列有关说法正确的是( )
| A、1H、D+、T2互为同位素 |
| B、H2O、CH3COOH、NH4HCO3都是电解质 |
| C、铝、铁、铜三者对应的氧化物均为碱性氧化物 |
| D、有单质参加的反应一定是氧化还原反应 |




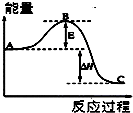 运用化学反应原理研究氮及其化合物的反应有重要意义.
运用化学反应原理研究氮及其化合物的反应有重要意义.