题目内容
6.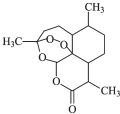 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素含有“-O-O-”键具有较强的氧化性 | |
| C. | 青蒿素易发生加成反应和氧化反应 | |
| D. | 青蒿素在碱性条件下易发生水解反应 |
分析 由结构可知分子式,分子中含5个环状结构,含-COOC-及1个过氧基团,结合酯的性质及C形成4个化学键来解答.
解答 解:A.由结构可知青蒿素分子式为C15H22O5,故A正确;
B.青蒿素含有“-O-O-”键,与过氧化氢性质相似,具有较强的氧化性,故B正确;
C.不能发生加成反应,故C错误;
D.含-COOC-,在碱性条件下易发生水解反应,故D正确;
故选C.
点评 本题考查有机物的结构性质,为高频考点,把握结构中的环状及酯的性质为解答的关键,侧重分析能力和知识迁移应用能力的考查,注意有机物分子式由结构中化学键分析,题目难度中等.

练习册系列答案
相关题目
16.X、Y、Z、W四种主族元素分属于元素周期表的前三周期,原子序数依次增加,它们原子的最外层电子数之和为15,Y2-和Z2+的电子层结构相同.下列说法正确的是( )
| A. | 氢化物的沸点:Y<W | |
| B. | 简单离子的半径:W>Y>Z>X | |
| C. | W的氧化物对应的水化物是一种强酸 | |
| D. | 与Z同族的下一周期元素的单质不能与N2反应 |
17.下列操作或装置能达到实验目的是( )
| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. |  直接蒸发氯化铁溶液获得氯化铁晶体 |
14.化学在工农业生产和日常生活中都有重要应用.下列叙述正确的是( )
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 酸雨是指pH<7.0的雨水 | |
| C. | 居室中放置一盆石灰水可以吸收CO,预防中毒 | |
| D. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 |
1.下列与社会、生活有关的说法不正确的是( )
| A. | 绿色化学的核心是从源头上防止和消除化工生产对环境的污染 | |
| B. | 减少化石燃料的使用,有利于降低空气中pM2.5的数值 | |
| C. | “地沟油”禁止食用,但可以用来制柴油、肥皂等 | |
| D. | 淀粉、豆油、蛋白质都是天然高分子化合物 |
18.下列说法中正确的是( )
| A. | 在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-═AgI↓ | |
| B. | NH4+的水解反应离子方程式:NH4++H2O?NH3•H2O+H+ | |
| C. | 镀铜时,阳极的电极反应式为:Cu2++2e-═Cu | |
| D. | 某反应△H<0,则该反应在任意条件下均可自发进行 |
15.某饱和一元醇的结构简式如下,其系统命名是( )


| A. | 2,2-二甲基戊醇 | B. | 2,2-二甲基-4-戊醇 | ||
| C. | 1,3,3-三甲基丁醇 | D. | 4,4-二甲基-2-戊醇 |
8.常温下,部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.76×10-5 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者大于后者 | |
| B. | 可发生反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| C. | Na+、CN-、CH3COO-、HCO3-等离子能大量共存 | |
| D. | 等浓度的CH3COONa和NaCN溶液pH前者小于后者 |