题目内容
18.A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红.(1)E的名称为硫;D的最高价氧化物的水化物的电子式:
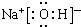 .AB-离子的电子式为
.AB-离子的电子式为 .
.(2)A、B、C的氢化物稳定性顺序为(用分子式表示)H2O>NH3>CH4;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为共价键和离子键.
(3)F2C和F2E中,沸点较高的是H2O (填化学式),其主要原因是水分子间存在氢键.
(4)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为HSO3-+H+=SO2↑+H2O.
(5)一定量的D2C2与AC2反应后的固体物质,恰好与含0.8mol HCl的稀盐酸完全反应,并收集0.25mol气体,则用物质的量表示该固体物质的组成为0.1molNa2CO3、0.3molNa2O2.
分析 根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与E的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,F元素的原子在周期表中半径最小,F应为H元素,据此答题.
解答 解:根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与E的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素,F元素的原子在周期表中半径最小,F应为H元素,
(1)E为S元素,名称为硫;钠的最高价氧化物对应的水化物为NaOH,它的电子式为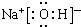 ;CN-电子式为
;CN-电子式为 ,
,
故答案为:硫;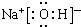 ;
; ;
;
(2)A、B、C分别为C、N、O元素,同一周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增大,所以A、B、C的氢化物稳定性由强到弱的顺序为H2O>NH3>CH4;
B为氮元素,所以B的氢化物和B的最高价氧化物的水化物反应生成Z,Z为NH4NO3,是离子化合物,在铵根离子与硝酸根离子之间是离子键,在铵根离子和硝酸根离子内部都有共价键,
故答案为:H2O>NH3>CH4;共价键和离子键;
(3)F2C和F2E分别为H2O和H2S,由于水分子间存在氢键,所以水的沸点高于硫化氢,
故答案为:H2O;水分子间存在氢键;
(4)C、D、E、F四种元素的两种化合物相互间发生反应,且生成气体,两种化合物为NaHSO3、NaHSO4,在溶液中发生反应的离子方程式为 HSO3-+H+=SO2↑+H2O.
故答案为:HSO3-+H+=SO2↑+H2O;
(5)由2Na2O2+2CO2═2Na2CO3+O2、Na2CO3+2HCl═2NaCl+CO2↑+H20、2Na2O2+4HCl═4NaCl+O2↑+2H20,
反应后的固体物质,恰好与0.8mol稀盐酸溶液完全反应,并收集到0.25mol气体,
设反应后Na2CO3、Na2O2的物质的量分别为x、y,
则$\left\{\begin{array}{l}{2x+2y=0.8}\\{x+\frac{y}{2}=0.25}\end{array}\right.$,解得x=0.1mol、y=0.3mol,
即该固体物质的组成为0.1molNa2CO3和0.3molNa2O2,
故答案为:0.1molNa2CO3、0.3molNa2O2.
点评 本题主要考查了原子结构与元素周期律的关系,题目难度中等,涉及电子式、元素周期律、化学键、离子反应、根据化学方程式的计算等知识点,解题的关键在于根据元素的性质确定元素种类,试题培养了学生的分析能力及灵活应用能力.

| A. | 利用核磁共振氢谱可以鉴别乙醇和甲醚 | |
| B. |  的一氯代物有4种 的一氯代物有4种 | |
| C. | 金刚烷( )分子中含有4个 )分子中含有4个 | |
| D. | 环戊二烯( )分子中最多有9个原子在同一平面上 )分子中最多有9个原子在同一平面上 |
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑤ | ⑦ | ⑨ | |||||
| 第3周期 | ① | ③ | ⑥ | ④ | ⑧ | ⑩ | ||
| 第4周期 | ② |
(2)元素最高价氧化物对应的水化物中,碱性最强的是KOH,该化合物与③的最高价氧化物的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)⑥、⑦、④三种元素形成气态氢化物的还原性由大到小的顺序是PH3>H2S>H2O.
(4)⑤、⑧的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
(5)两种均含①④⑦和氢元素四种元素的化合物相互反应的化学方程式为NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O.
(6)元素⑤的最高价含氧酸,与76.8mg的Cu反应,Cu完全溶解,酸根离子减少了2.2×10-3mol,则H+的变化情况是减少(增加、减少、不变)4.6×10-3mol.
 图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( ) ①食盐水 ②BaCl2溶液 ③适量稀盐酸
④Na2CO3溶液 ⑤CCl4 ⑥浓氨水 ⑦苯.
| A. | ①③⑤ | B. | ②⑥ | C. | ①②③⑤⑦ | D. | ①②④ |
| A. | 将食物置于冰箱中冷藏保存 | B. | 将FeCl3加入H2O2溶液中制备O2 | ||
| C. | 将洗衣粉溶于温水后洗涤衣服 | D. | 将CaCO3固体研磨后再与稀HCl反应 |
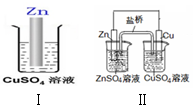
| A. | Ⅱ中盐桥中的Cl-移向ZnSO4溶液 | |
| B. | Ⅰ、Ⅱ的反应原理均是Zn+Cu2+=Zn2++Cu | |
| C. | Ⅰ、Ⅱ中均有电子转移,均是把化学能转化成电能利用 | |
| D. | 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅 |
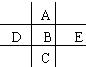 如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: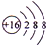 .A单质的电子式为
.A单质的电子式为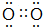 .
.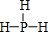 .
. )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂为多.
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂为多.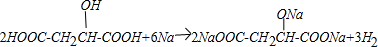 .
. .
.