题目内容
20.氮化铝具有耐高温、抗冲击、导热性好等优良性能,在电子工业、陶瓷工业等领域有广泛应用.其合成反应为:Al2O3+N2+3C=2AlN+3CO,下列说法不正确的是( )| A. | C作还原剂,在反应中被氧化 | |
| B. | 每转移2mol e-时,可产生1mol CO | |
| C. | N2作氧化剂,AlN是还原产物 | |
| D. | 欲制得2molAlN,实际消耗N2体积大于22.4L |
分析 Al2O3+N2+3C═2AlN+3CO中,N元素化合价降低,N2为氧化剂,C元素化合价升高,C为还原剂,上述反应中N元素化合价由0价降低到-3价,每生成2mol AlN,N2得到6mol电子,由此分析解答.
解答 解:A、C作还原剂,在反应中发生氧化反应,被氧化,故A正确;
B、N元素化合价由0价降低到-3价,每生成2mol AlN,N2得到6mol电子,同时生成3mol的一氧化碳,所以每转移2mol e-时,可产生1mol CO,故B正确;
C、N元素化合价降低,N2为氧化剂,所以AlN是还原产物,故C正确;
D、状况不知无法求体积,故D错误;
故选D.
点评 本题考查氧化还原反应,题目难度不大,注意把握元素化合价的判断,从化合价变化的角度分析,题目侧重于相关概念的考查.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
8.综合如图判断,下列叙述不正确的是(Ⅱ中盐桥为KCl溶液)( )
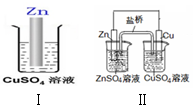

| A. | Ⅱ中盐桥中的Cl-移向ZnSO4溶液 | |
| B. | Ⅰ、Ⅱ的反应原理均是Zn+Cu2+=Zn2++Cu | |
| C. | Ⅰ、Ⅱ中均有电子转移,均是把化学能转化成电能利用 | |
| D. | 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅 |
5.已知可逆反应2SO2+O2?2SO3,当生成2mol SO3时放出热量为Q,现将2mol SO2和1mol O2在相同条件下反应生成SO3,放出的热量为Q1,则( )
| A. | Q1=Q | B. | Q1>Q | C. | Q1<Q | D. | 无法判断 |
12.下列各组离子在指定条件下,一定能大量共存的是( )
| A. | pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- | |
| B. | 能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- | |
| C. | 使酚酞变红的溶液:Ba2+、Na+、Cl-、NO3- | |
| D. | 能溶解Al(OH)3固体的溶液:K+、Na+、HCO3--、NO3-- |
9.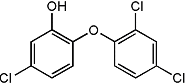 三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
 三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )| A. | 物质的分子式为C12H7Cl3O2 | |
| B. | 该物质苯环上的一溴取代物有6种 | |
| C. | 该物质中含有四种官能团 | |
| D. | 该物质中所有原子都可能处于同一平面 |
10.下列反应的离子方程式正确的是( )
| A. | Ca(HCO2)2溶液中加入过量NaOH溶液Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 酸性条件下KIO3溶液与KI溶液反应IO${\;}_{3}^{-}$+5I-+3H2O═3I2+6OH- | |
| C. | AlCl3溶液中加入少量Na 2Al3++6Na+6H2O═2Al(OH)3↓+6Na++3H2↑ | |
| D. | FeBr2溶液中通入少量Cl2 2Fe2++4Br+3Cl2→2Fe3++2Br2+6Cl- |
 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂为多.
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂为多.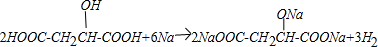 .
. .
.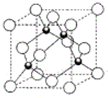 原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中最丰富的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中最丰富的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29. 某小组为研究电化学原理,设计如图所示装置:
某小组为研究电化学原理,设计如图所示装置: