题目内容
2.下列有关化学用语表达正确的是( )| A. | 氨分子的电子式: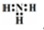 | |
| B. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | O2-的结构示意图为: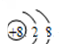 | |
| D. | ${\;}_{35}^{79}$Br的基态原子电子排布式:[Ar]4S24P5 |
分析 A.氨气分子的电子式中漏掉了氮原子的1对未成键电子;
B.质量数=质子数+中子数,该氯原子的质量数为37;
C.O2-的质子数是8,电子数是10;
D.Br元素为35号元素,原子核外有35个电子,所以核外电子排布式为:1s22s22p63s23p63d104s24p5.
解答 解:A.氨气分子中氮原子最外层达到8电子稳定结构,漏掉了氮原子的一对孤电子对,氨气的电子式为 ,故A错误;
,故A错误;
B.质子数为17、中子数为20的氯原子的质量数为37,其正确的表示方法为:1737Cl,故B错误;
C.O2-的质子数是8,电子数是10,结构示意图为: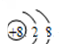 ,故C正确;
,故C正确;
D.Br元素为35号元素,原子核外有35个电子,所以核外电子排布式为:[Ar]3d104s24p5,故D错误.
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、元素符号、离子结构示意图、电子排布式等知识,明确常见化学用语的书写原则为解答结构,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
19.今有原子序数依次培大的A.B、C、D、E、F六种元素.已知A、C、E三元素原子的最外层共有10个电子.且这三种元素的最高价氧化物对应的水化物之间,两两皆能反应且均能生成盐和水.D和F各有如下表的电子层结构.
按要求填空:
(1)各元素的元素符号分别为BMg,ES,FCl;
(2)试写出A、C最高价氧化物对应的水化物之间反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O
(3)D、E氢化物的稳定性:H2S>SiH4
(4)试写出A、B、E、F形成的简单离子半径由小到大的顺序:S2->Cl->Na+>Mg2+.
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| F | x+3 | x+4 |
(1)各元素的元素符号分别为BMg,ES,FCl;
(2)试写出A、C最高价氧化物对应的水化物之间反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O
(3)D、E氢化物的稳定性:H2S>SiH4
(4)试写出A、B、E、F形成的简单离子半径由小到大的顺序:S2->Cl->Na+>Mg2+.
7.对于在密闭容器中进行的工业合成氨的反应:N2+3H2?2NH3,下列说法错误的是 ( )
| A. | 使用合适的催化剂可以增大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大压强不影响反应速率 | |
| D. | 增大N2浓度可以增大反应速率 |
14.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 能使甲基橙变红的溶液中:Na+、K+、SO${\;}_{4}^{2-}$、AlO${\;}_{2}^{-}$ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液中:Cu2+、Mg2+、SO42-、NO${\;}_{3}^{-}$ | |
| C. | 0.1mol•L-1FeCl2溶液中:Al+、Ca2+、SCN-、ClO- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ |
11.根据元素周期律及物质结构的有关知识,判断以下有关排序不正确的是( )
| A. | 原子半径:Al>Mg>Na | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 酸性:HClO4>H2SO4>H2PO4 | D. | 金属性:Na>Mg>Al |
12.下列事实与胶体性质有关的是( )
| A. | 用盐卤点豆腐 | B. | 用明矾净水 | ||
| C. | 医药是用三氯化铁止血 | D. | 江河入海中形成的三角洲 |
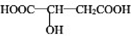 )常用于汽水、糖果的添加剂,
)常用于汽水、糖果的添加剂,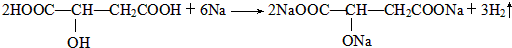 ;
;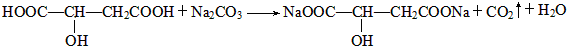
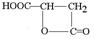 .
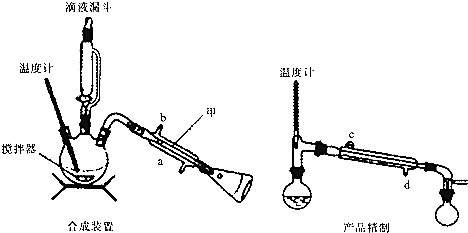
. 实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.