题目内容
14.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 能使甲基橙变红的溶液中:Na+、K+、SO${\;}_{4}^{2-}$、AlO${\;}_{2}^{-}$ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液中:Cu2+、Mg2+、SO42-、NO${\;}_{3}^{-}$ | |
| C. | 0.1mol•L-1FeCl2溶液中:Al+、Ca2+、SCN-、ClO- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ |
分析 A.能使甲基橙变红的溶液呈酸性;
B.$\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液呈酸性;
C.与Fe2+发生反应的离子不能大量共存;
D.水电离的c(H+)=1×10-13mol•L-1的溶液可能呈酸性或碱性.
解答 解:A.能使甲基橙变红的溶液呈酸性,酸性条件下AlO2-不能大量共存,故A错误;
B.$\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液呈酸性,离子之间不发生任何反应,可大量共存,故B正确;
C.ClO-与Fe2+发生氧化还原反应而不能大量共存,故C错误;
D.水电离的c(H+)=1×10-13mol•L-1的溶液可能呈酸性或碱性,酸性条件下CO32-不能大量共存,碱性条件下NH4+不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
5.关于酯的下列说法正确的是( )
| A. | 酯有刺激性气味 | B. | 油脂属于酯类 | ||
| C. | 酯难溶于水且密度大于水 | D. | 酯化反应中用NaOH溶液做催化剂 |
2.下列有关化学用语表达正确的是( )
| A. | 氨分子的电子式: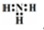 | |
| B. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | O2-的结构示意图为: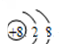 | |
| D. | ${\;}_{35}^{79}$Br的基态原子电子排布式:[Ar]4S24P5 |
9.下列过程中吸收热量的是( )
| A. | 液氨气化 | B. | 酸城中和 | C. | 浓硫酸加水稀释 | D. | 镁条与盐酸反应 |
19.为提纯下列物质(括号中为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 除杂试剂 | 分离方法 | |
| A | 碳酸氢钠(碳酸钠) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氧化铁(氧化铝) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
6.目前,CO、CO2的有效开发利用成为科学家研究的重要课题.

Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)?CH3OH(g)的△H=-90.1kJ•mol-1.
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)>ω(B)(填“>”、“<”或“=”),理由为A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动.
②C、D两点的逆反应速率:v正(C)>v逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为0<x<58.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是B(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:①NaHC2O4②HNO3③HClO,溶液中的n(HCO3-)与所加入溶液体积(V)的关系如图2所示.其中,符合曲线Ⅰ的溶液为①②(填序号,下同);符合曲线Ⅱ的溶液为③.

Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)?CH3OH(g)的△H=-90.1kJ•mol-1.
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)>ω(B)(填“>”、“<”或“=”),理由为A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动.
②C、D两点的逆反应速率:v正(C)>v逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为0<x<58.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是B(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |

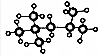 ,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;
,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;