题目内容
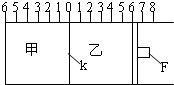 Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:(1)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是
(2)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为
(3)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于
Ⅱ.若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是
考点:化学平衡的计算
专题:
分析:Ⅰ.(1)该反应正向为体积缩小的反应,当物质的量不变时平衡,此时隔板K、F不再移动,根据可逆反应的特征分析;
(2)根据化学平衡常数表达式的概念,结合条件中给出的可逆反应方程式解答;
(3)根据等效平衡和可逆反应的特征判断;
Ⅱ.(1)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;体积不变,两边转化结果相同,左边甲容器中A转化了2b,右边乙容器中含有2b的C,依据转化率概念计算得到;
(2)根据压强之比等于气体物质的量之比,依据极值分析判断.
(2)根据化学平衡常数表达式的概念,结合条件中给出的可逆反应方程式解答;
(3)根据等效平衡和可逆反应的特征判断;
Ⅱ.(1)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;体积不变,两边转化结果相同,左边甲容器中A转化了2b,右边乙容器中含有2b的C,依据转化率概念计算得到;
(2)根据压强之比等于气体物质的量之比,依据极值分析判断.
解答:
解:Ⅰ.(1)根据反应式2A(g)+B(g)?2C(g) 可知反应达平衡时气体物质的量减小,当物质的量不变时平衡,此时隔板K、F不再移动,当乙中没有He气时,甲中充入2molA、1molB,与乙中充入2molC到达平衡状态时,为等效的,即两边气体的物质的量相等,隔板应位于中间0处,此后向乙中再充入1molHe气,会使乙中气体压强增大,隔板向甲的方向移动,会使甲中的反应向正向移动,再次到达平衡时,隔板位于a处,通过观察,当反应未开始时隔板位于0处,每一个格相当于0.5mol气体.隔板在a处时,甲中的气体为0.5×(6-a)mol.
设甲中反应到达平衡时,有xmolB发生反应,
2A(g)+B(g)?2C(g)
开始(mol) 2 1 0
转化(mol) 2x x 2x
平衡(mol) (2-2x) (1-x) 2x
(2-2x)+(1-x)=(6-a)×0.5 0.5a=x
当B完全反应时,x=1,a取最大,即a=2
2molA和1molB完全反应时生成2molC,根据可逆反应不能进行到底可知:K停留在0~2之间某位置,
故答案为:0<a<2;
(2)根据题中的条件,当到达平衡时,隔板位于左侧1处,则说明乙端的相当有7个格,即乙中平衡时气体的物质的量为3.5mol,其中He为1mol.
设乙中到达平衡时有ymolC反应
2C(g)?2A(g)+B(g)
开始(mol) 2 0 0
转化(mol) y y
y
平衡(mol) (2-y) y
y
(2-y)+y+
y=2.5 y=1,
则甲中C的物质的量为1mol,A的物质的量为1mol,B的物质的量为0.5mol,甲容积为2L,
根据化学平常数表达式的概念,生成物浓度计量系数次方的乘积与反应物浓度计量系数次方的乘积的比值,K=
=
=4,
故答案为:4;
(3)根据题中信息可知,甲和乙是在恒温恒压条件下的反应,属于等效平衡,若平衡时K停留在0处,说明甲中平衡混合物为3mol,如乙平衡不移动,乙中为C和He,共4mol,体积为8,F应停留在8处,但因为等同于此时再向乙中通入1molHe,2C(g)?2A(g)+B(g),会使乙中气体压强增大,隔板向甲的方向移动,则活塞F应停留在右侧不大于8处,
故答案为:8;
Ⅱ.(1)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;体积不变,两边转化结果相同,左边甲容器中甲中A的转化率为b,则A转化了2b,右边乙容器中含有2b的C物质,乙中C的转化率=
=1-b;
故答案为:1-b;
(2)此题仍要考虑两种极限情况,即乙、甲完全转化与乙、甲完全不转化,当乙完全不转化、甲完全转化时,恒容,d=
=
=
;当乙完全转化、甲完全不转化时,恒容,d=
=
=
,因此d的取值范围是
<d<
,
故答案为:
<d<
.
设甲中反应到达平衡时,有xmolB发生反应,
2A(g)+B(g)?2C(g)
开始(mol) 2 1 0
转化(mol) 2x x 2x
平衡(mol) (2-2x) (1-x) 2x
(2-2x)+(1-x)=(6-a)×0.5 0.5a=x
当B完全反应时,x=1,a取最大,即a=2
2molA和1molB完全反应时生成2molC,根据可逆反应不能进行到底可知:K停留在0~2之间某位置,
故答案为:0<a<2;
(2)根据题中的条件,当到达平衡时,隔板位于左侧1处,则说明乙端的相当有7个格,即乙中平衡时气体的物质的量为3.5mol,其中He为1mol.
设乙中到达平衡时有ymolC反应
2C(g)?2A(g)+B(g)
开始(mol) 2 0 0
转化(mol) y y
| 1 |
| 2 |
平衡(mol) (2-y) y
| 1 |
| 2 |
(2-y)+y+
| 1 |
| 2 |
则甲中C的物质的量为1mol,A的物质的量为1mol,B的物质的量为0.5mol,甲容积为2L,
根据化学平常数表达式的概念,生成物浓度计量系数次方的乘积与反应物浓度计量系数次方的乘积的比值,K=
| c2(C) |
| c2(A)?c(B) |
| 0.52 |
| 0.52×0.25 |
故答案为:4;
(3)根据题中信息可知,甲和乙是在恒温恒压条件下的反应,属于等效平衡,若平衡时K停留在0处,说明甲中平衡混合物为3mol,如乙平衡不移动,乙中为C和He,共4mol,体积为8,F应停留在8处,但因为等同于此时再向乙中通入1molHe,2C(g)?2A(g)+B(g),会使乙中气体压强增大,隔板向甲的方向移动,则活塞F应停留在右侧不大于8处,
故答案为:8;
Ⅱ.(1)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;体积不变,两边转化结果相同,左边甲容器中甲中A的转化率为b,则A转化了2b,右边乙容器中含有2b的C物质,乙中C的转化率=
| 2-2b |
| 2 |
故答案为:1-b;
(2)此题仍要考虑两种极限情况,即乙、甲完全转化与乙、甲完全不转化,当乙完全不转化、甲完全转化时,恒容,d=
| P乙 |
| P甲 |
| n乙 |
| n甲 |
| 3 |
| 2 |
| P乙 |
| P甲 |
| n乙 |
| n甲 |
| 4 |
| 3 |
| 4 |
| 3 |
| 3 |
| 2 |
故答案为:
| 4 |
| 3 |
| 3 |
| 2 |
点评:本题综合系统的考查了化学平衡的基本知识,平衡状态的判断,化学平衡移动原理的应用,化学平衡的计算等知识,注意分析反应的可逆性特征和两容器压强相等,这两个角度是解答该题的关键,题目较难.

练习册系列答案
相关题目
一定温度下的恒容容器中,能标志某可逆反应A(s)+2B(g)?C(g)+D(g)已达平衡状态的是( )
| A、混合气体的压强不随时间变化而变化 |
| B、气体的平均分子量不再变化 |
| C、2 v (B)正=v (D)逆 |
| D、单位时间内消耗n mol C,同时生成2n mol B |
下列关于有机物的叙述,正确的是( )
| A、石油的分馏和煤的气化都是发生了化学变化 |
| B、苯、溴水、铁粉混合可制成溴苯 |
| C、苯在一定条件下既能发生取代反应,又能发生加成反应,但不能发生氧化反应 |
| D、纤维素、油脂和蛋白质在一定条件下都能水解 |
向浓度为0.1mol?L-1的K2CO3溶液中分别加入下列物质,能使C(CO32-)增大的是( )
| A、H2O |
| B、CO2 |
| C、KHSO4固体 |
| D、KOH固体 |
下列反应中,属于氧化还原反应,但不属于四种基本反应类型的是( )
| A、CaO+H2O═Ca(OH)2 | ||||
| B、Zn+2HCl═ZnCl2+H2↑ | ||||
C、2NaCl+2H2O
| ||||
| D、NaCl+AgNO3═AgCl↓+NaNO3 |
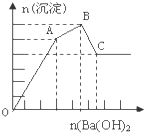 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( ) | 氢氧化物 | 溶液PH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)2 | 2.3 | 3.4 | - | - |
| Al(OH)2 | 3.3 | 5.2 | 7.8 | 12.8 |
| A、C点的沉淀为:Fe(OH)3和 BaSO4 |
| B、OA段可能发生的反应有:3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ |
| C、AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-→2BaSO4↓+Al(OH)3↓ |
| D、据图计算原溶液中c(Cl-)=c(SO42-) |
 如图是金属钨晶体中的
如图是金属钨晶体中的