题目内容
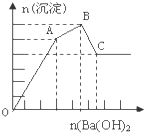 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( ) | 氢氧化物 | 溶液PH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)2 | 2.3 | 3.4 | - | - |
| Al(OH)2 | 3.3 | 5.2 | 7.8 | 12.8 |
| A、C点的沉淀为:Fe(OH)3和 BaSO4 |
| B、OA段可能发生的反应有:3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ |
| C、AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-→2BaSO4↓+Al(OH)3↓ |
| D、据图计算原溶液中c(Cl-)=c(SO42-) |
考点:离子方程式的有关计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:向含Al2(SO4)3 和 FeCl3的混合溶液与Ba(OH)2溶液反应的实质是Fe3+,Al3+与OH-、Ba2+与SO42-之间的离子反应,如下:
Ba2++SO42-═BaSO4↓,Fe3++3OH-=Fe(OH)3↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离了,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol;
Ba2++SO42-═BaSO4↓,Fe3++3OH-=Fe(OH)3↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离了,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol;
解答:
解:向含Al2(SO4)3 和 FeCl3的混合溶液与Ba(OH)2溶液反应的实质是Fe3+,Al3+与OH-、Ba2+与SO42-之间的离子反应,如下:
Ba2++SO42-═BaSO4↓,Fe3++3OH-=Fe(OH)3↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离了,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol;
A、分析可知,C点沉淀为BaSO4 和Fe(OH)3,故A正确;
B、OA段可能发生的反应有沉淀钡离子,铁离子,铝离子,反应为,3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓,也可能发生3Ba2++6OH-+3SO42-+2Fe3+→3BaSO4↓+2Fe(OH)3↓,故B正确;
C、AB段可能发生的反应是Al3++3OH-→Al(OH)3↓,故C错误;
D、图象分析FeCl3、Al2(SO4)3的混和溶液中含FeCl3、1mol,含Al2(SO4)31mol,则c(Cl-)=c(SO42-),故D正确;
故选C.
Ba2++SO42-═BaSO4↓,Fe3++3OH-=Fe(OH)3↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离了,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol;
A、分析可知,C点沉淀为BaSO4 和Fe(OH)3,故A正确;
B、OA段可能发生的反应有沉淀钡离子,铁离子,铝离子,反应为,3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓,也可能发生3Ba2++6OH-+3SO42-+2Fe3+→3BaSO4↓+2Fe(OH)3↓,故B正确;
C、AB段可能发生的反应是Al3++3OH-→Al(OH)3↓,故C错误;
D、图象分析FeCl3、Al2(SO4)3的混和溶液中含FeCl3、1mol,含Al2(SO4)31mol,则c(Cl-)=c(SO42-),故D正确;
故选C.
点评:本题考查化学反应的有关图象问题、铝化合物性质、混合物的有关计算等,难度较大,关键是清楚各阶段发生的反应,注意从开始到A点相当于是硫酸铝与氢氧化钡的反应生成硫酸钡、氢氧铁沉淀.

练习册系列答案
相关题目
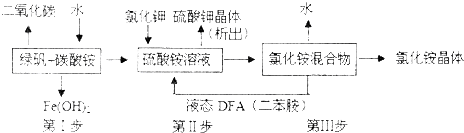
强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:下列结论正确的是( )


| A、X中不能确定的离子是 A13+、Na+、K+和C1- |
| B、气体F经催化氧化可直接生成气体D |
| C、沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 |
| D、X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- |
下列关于同分异构体、同系物、同素异形体、同位素的说法中错误的是( )
| A、乙酸与甲酸甲酯互为同分异构体 | ||||
B、
| ||||
| C、氧气与臭氧互为同素异形体 | ||||
| D、乙烯与聚乙烯互为同系物 |
下列反应的离子方程式书写正确的是( )
| A、铝与稀硫酸反应:Al+2H+=Al3++H2↑ |
| B、碳酸钙与稀盐酸的反应:CO32-+2H+=CO2+H2O |
| C、氨水与盐酸反应:OH-+H+=H2O |
| D、实验室用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
下列溶液在空气中加热、蒸干、灼烧后,所得固体为原溶液中的溶质的是( )
| A、(NH4)2SO3 |
| B、KMnO4 |
| C、AlCl3 |
| D、Na2CO3 |
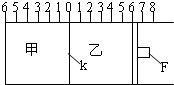 Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题: