题目内容
标准状况下4.48L CO2与100mL,3mol/L的NaOH完全反应,则
(1)所得溶液中的溶质成分是什么?
(2)所得溶液中的物质的量是多少?
(1)所得溶液中的溶质成分是什么?
(2)所得溶液中的物质的量是多少?
考点:化学方程式的有关计算
专题:计算题
分析:首先计算CO2和NaOH的物质的量,判断反应产物,列方程式计算相关物理量.
解答:
解:(1)n (CO2)=
=0.2mol,n(NaOH)=0.1L×3mol/L=0.3mol,
则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,
则有:2>
=
>1,
所以:所得产物为Na2CO3和NaHCO3,
答:所得溶液中含Na2CO3和NaHCO3两种溶质;
(2)设所得产物中含Na2CO3为xmol,NaHCO3为ymol则得方程组:
解得:x=0.1,y=0.1,
答:Na2CO3和NaHCO3两种溶质的物质的量都为0.1mol.
| 4.48L |
| 22.4L/mol |
则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,
则有:2>
| n(NaOH) |
| n(CO2) |
| 3 |
| 2 |
所以:所得产物为Na2CO3和NaHCO3,
答:所得溶液中含Na2CO3和NaHCO3两种溶质;
(2)设所得产物中含Na2CO3为xmol,NaHCO3为ymol则得方程组:
|
解得:x=0.1,y=0.1,
答:Na2CO3和NaHCO3两种溶质的物质的量都为0.1mol.
点评:本题考查化学方程式的相关计算,题目难度不大,注意正确判断产物的成分为解答该题的关键.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
常温下在密闭容器中通入2mL某烷烃和13mL O2,点火爆炸后去掉生成的CO2和H2O,再通入6mL O2,再点火爆炸,此时O2有剩余.求烷烃的分子式和可能的结构简式.若其一卤代物有4种,命名此烷烃.
 某工厂排出的污水中含有大量的Fe3+、Zn2+、Hg2+三种金属离子.以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4?7H2O)和汞的方案.
某工厂排出的污水中含有大量的Fe3+、Zn2+、Hg2+三种金属离子.以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4?7H2O)和汞的方案.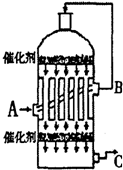 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.

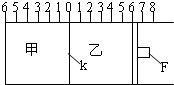 Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题: