题目内容
向浓度为0.1mol?L-1的K2CO3溶液中分别加入下列物质,能使C(CO32-)增大的是( )
| A、H2O |
| B、CO2 |
| C、KHSO4固体 |
| D、KOH固体 |
考点:盐类水解的原理
专题:
分析:K2CO3溶液中存在CO32-+H2O?HCO3-+OH-,能使C(CO32-)增大,应抑制能使CO32-增大的水解,以此解答该题.
解答:
解:A.加入水,溶液体积增大,C(CO32-)减小,故A错误;
B.通入二氧化碳,反应生成HCO3-,C(CO32-)减小,故B错误;
C.加入KHSO4固体,可生成二氧化碳或HCO3-,C(CO32-)减小,故C错误;
D.加入KOH固体,OH-浓度增大,抑制CO32-的水解,C(CO32-)增大,故D正确.
故选D.
B.通入二氧化碳,反应生成HCO3-,C(CO32-)减小,故B错误;
C.加入KHSO4固体,可生成二氧化碳或HCO3-,C(CO32-)减小,故C错误;
D.加入KOH固体,OH-浓度增大,抑制CO32-的水解,C(CO32-)增大,故D正确.
故选D.
点评:本题考查盐类水解的影响,为高频考点,侧重于学生的分析能力的考查,注意把握盐类水解的原理以及影响因素,注意相关基础知识的学习,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(提示:NH4++OH-
NH3↑+H2O)(1)第一份加入AgNO3溶液有沉淀产生(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.下列判断正确的是( )
| ||
| A、K+不一定存在 |
| B、K+、NH4+、CO32-、SO42- 一定存在 |
| C、Cl-一定存在 |
| D、Cl-、Mg2+、Ba2+一定不存在 |
甲、乙两容器都发生反应2A(g)+B(g)?3C(g),两容器温度和初始压强都相同.在甲恒容容器中充入2mol A和1mol B,达平衡后,C在平衡混合气中的体积分数为φ1、物质的量为n1;在乙恒压容器中充入1.4mol A、0.7mol B和0.6mol C,达平衡后C在平衡混合气中的体积分数为φ2、物质的量为n2.下列说法中正确的是( )
| A、φ1>φ2 |
| B、n1>n2 |
| C、n1=n2 |
| D、φ1<φ2 |
白黎芦醇: 广泛存在于食物中,它可能具有抗癌性,能与1mol该化合物起反应的Br2或H2的最大用量分别为( )
广泛存在于食物中,它可能具有抗癌性,能与1mol该化合物起反应的Br2或H2的最大用量分别为( )
 广泛存在于食物中,它可能具有抗癌性,能与1mol该化合物起反应的Br2或H2的最大用量分别为( )
广泛存在于食物中,它可能具有抗癌性,能与1mol该化合物起反应的Br2或H2的最大用量分别为( )| A、1mol,7mol |
| B、3.5mol,7mol |
| C、3mol,6mol |
| D、6mol,7mol |

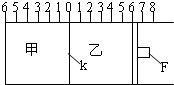 Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题: