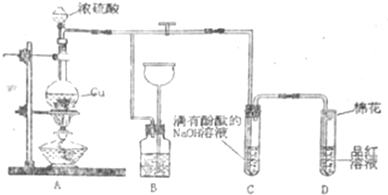
题目内容
15.人的纯净胃液是一种无色液体,呈酸性,pH在0.9~1.5之间,其中H+的浓度比血液中高几万倍,回答下列问题:①胃液有帮助人体消化食物等多种功能,胃酸的主要成分是盐酸.
②若胃酸酸度增高就会患胃酸过多症,下列物质不宜用做治疗胃酸过多的药物的是C
A、小苏打粉 B、氢氧化铝粉 C、氢氧化钠粉末 D、纯碳酸钙粉
③胃舒平主要成分是氢氧化铝,不溶于水且作用持久,写出该药物中和胃酸的化学方程式:Al(OH)3+3H+=Al3++3H2O.
分析 (1)胃酸的主要成分是盐酸;
(2)氢氧化钠碱性很强会损害胃黏膜;
(3)氢氧化铝与盐酸反应生成氯化铝和水.
解答 解:(1)胃酸的主要成分是盐酸,故答案为:盐酸;
(2)当胃酸过多时,不宜选用氢氧化钠,氢氧化钠碱性很强会损害胃黏膜,故选C;
(3)氢氧化铝与盐酸反应生成氯化铝和水,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O.
点评 本题考查胃酸的成分和抗酸药,明确发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
5.瓦斯中氧气与甲烷的质量比为4﹕1时极易爆炸,此时氧气与甲烷的体积比为( )
| A. | 2﹕1 | B. | 1﹕2 | C. | 1﹕1 | D. | 1﹕4 |
6.X、Y、Z、W为四种短周期主族元素,且原子序数依次增大,其中X、Z同族,Y是短周期主族元素中原子半径最大的,X是农作物生长的三种必须营养元素之一,W的单质以前常用于自来水消毒.下列说法正确的是( )
| A. | Z的最高价氧化物的水化物能形成多种含Y元素的盐 | |
| B. | W的氧化物对应水化物的酸性一定强于Z | |
| C. | Y的单质应该保存在水中 | |
| D. | X的氢化物沸点比Z的氢化物沸点低 |
10.金属钠着火时,可采用的灭火物质是( )
| A. | CO2 | B. | 水 | ||
| C. | 干沙 | D. | 干粉(含NaHCO3)灭火剂 |
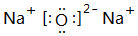 、
、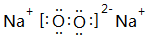 .
.