题目内容
12.下列实验事实以及所得出的相应结论不正确的是( )| 实 验 事 实 | 结 论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶不能保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,滴加稀盐酸,沉淀不溶解 | 证明Na2SO3已氧化变质 |
| ④ | 某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,向该溶液中滴加BaCl2溶液,有白色沉淀生成 | 确定该溶液中存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红 | 该溶液一定有NH4+ |
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | 全部 |
分析 ①二氧化硫具有还原性,能被强氧化剂氧化;
②二氧化硅和NaOH反应不属于氧化还原反应;
③亚硫酸钠在酸性条件下能被硝酸钡氧化生成硫酸钡;
④某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明阴离子是碳酸根离子或碳酸氢根离子;向该溶液中滴加BaCl2溶液,有白色沉淀生成,说明有碳酸根离子;
⑤该溶液也可能是氨水.
解答 解:①二氧化硫具有还原性,能被强氧化剂氧化,高锰酸钾溶液具有强氧化性,能和二氧化硫发生氧化还原反应而导致酸性高锰酸钾溶液褪色,该实验体现二氧化硫还原性,故错误;
②二氧化硅和NaOH反应不属于氧化还原反应,该反应中没有电子转移,故错误;
③亚硫酸钠在酸性条件下能被硝酸钡氧化生成硫酸钡,生成的不是亚硫酸钡,故错误;
④某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明阴离子是碳酸根离子或碳酸氢根离子;向该溶液中滴加BaCl2溶液,有白色沉淀生成,说明有碳酸根离子,所以该实验结论正确,故正确;
⑤生成的气体是氨气,但该溶液也可能是氨水,故错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断能力,明确实验原理、物质性质是解本题关键,注意二氧化硫漂白性和还原性区别,易错选项是⑤.

练习册系列答案
相关题目
16.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 将lL2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| B. | 1L0.1mol/LNaHSO4溶液中含有0.1 Na个HSO4- | |
| C. | 常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | lmol铁与足量稀盐酸反应转移的电子数目为3NA |
3.下列说法不正确的是( )
| A. | 通过质谱法只能确认化合物的相对分子质量,一般无法确定其结构 | |
| B. | 甲苯分子的核磁共振氢谱中有2个不同的吸收峰 | |
| C. | 红外光谱可以帮助确定许多有机物结构 | |
| D. | 某有机物完全燃烧只生成CO2和H2O,两者的物质的量之比为1:2,则该有机物可能为甲烷或甲醇 |
20.某温度下,0.1mol/L NaHS溶液显碱性,则下列关系式或说法中不正确的是( )
| A. | c(Na+)=c(HS-)+2c(S2-)+c(OH-) | |
| B. | c(H2S)+c(HS-)+c(S2-)=0.1 mol/L | |
| C. | 将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变 | |
| D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
7.在两个密闭容器中,分别充有质量相等的N2、O2两种气体,它们的温度和密度均相同.下列说法中正确的是( )
| A. | 分子数:N2<O2 | B. | 气体摩尔体积:N2<O2 | ||
| C. | 气体的压强:N2<O2 | D. | 体积:N2<O2 |
1. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$.
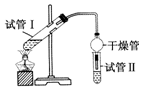
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol•L-1.
②分析实验A(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
③加热有利于提高乙酯乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$.
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验A(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
③加热有利于提高乙酯乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
2.类推法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否.根据你所掌握的知识,判断下列类推结论中正确的是( )
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<I2 | 氢化物沸点:HF<HCl<HBr<HI |
| B | 用电解熔融MgCl2可制得金属镁 | 用电解熔融NaCl也可以制取金属钠 |
| C | 将CO2通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | Al与S加热时直接化合生成Al2S3 | Fe与S加热时也能直接化合生成 Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |