题目内容
7.在两个密闭容器中,分别充有质量相等的N2、O2两种气体,它们的温度和密度均相同.下列说法中正确的是( )| A. | 分子数:N2<O2 | B. | 气体摩尔体积:N2<O2 | ||
| C. | 气体的压强:N2<O2 | D. | 体积:N2<O2 |
分析 相同体积相同密度时,两容器气体的质量相等,结合PV=nRT和分子的组成判断.
解答 解:A、两者质量相等,但摩尔质量不等,所以物质的是量不等,分子数不等,摩尔质量越大物质的量越小,所以分子数:N2>O2,故A错误;
B、有质量、密度均相同,所以气体体积相同,而物质的量越大,气体摩尔体积越小,气体摩尔体积:N2<O2,故B正确;
C、由PV=nRT可知,两种气体的压强之比与摩尔质量成反比,为32:28,所以气体的压强:N2>O2,故C错误;
D、有质量、密度均相同,所以气体体积相同,故D错误;
故选B.
点评 本题考查阿伏加德罗定律及其推论,题目难度不大,本题注意把握两种气体的元素组成特点,结合PV=nRT判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列实验事实以及所得出的相应结论不正确的是( )
| 实 验 事 实 | 结 论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶不能保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,滴加稀盐酸,沉淀不溶解 | 证明Na2SO3已氧化变质 |
| ④ | 某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,向该溶液中滴加BaCl2溶液,有白色沉淀生成 | 确定该溶液中存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红 | 该溶液一定有NH4+ |
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | 全部 |
19.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温下,46g NO2和N2O4含有2NA个氧原子 | |
| B. | 1mol Na中约含NA个电子 | |
| C. | 4gNaOH中含有NA个OH- | |
| D. | 标况下,22.4LHF中含有NA个HF分子 |
17.下列变化需要加入还原剂才能实现的( )
| A. | MnO4→Mn2- | B. | HCl→Cl2 | C. | Fe→Fe3- | D. | KClO3→O2 |
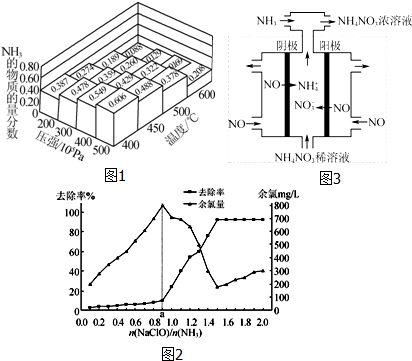
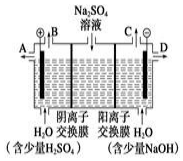
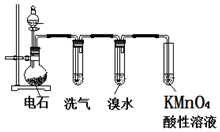 如图为实验室制取乙炔并验证其性质的装置图,回答下列问题:
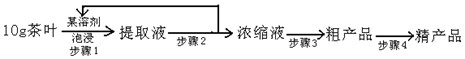
如图为实验室制取乙炔并验证其性质的装置图,回答下列问题: ,实验室可通过下列简单方法从茶叶中提取咖啡因:
,实验室可通过下列简单方法从茶叶中提取咖啡因: