题目内容
7.加热10g碳酸钠和碳酸氢钠的混合物至质量不在变化,剩余固体的质量为6.9g,求原混合物中碳酸钠的质量和质量分数.分析 加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,导致固体质量减少,计算固体质量差,根据差量法计算碳酸氢钠的质量,进而计算碳酸钠的质量与质量分数.
解答 解:固体质量减少为10g-6.9g=3.1g,
设混合物中碳酸氢钠的质量为m,利用差量法计算,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 固体质量减少△m
2×84g 62g
m 3.1g
所以m=$\frac{2×84g×3.1g}{62g}$=8.4g,
所以混合物中碳酸钠的质量为10g-8.4g=1.6g,
混合物中碳酸钠的质量分数=$\frac{1.6g}{10g}$×100%=16%,
答:混合物中碳酸钠的质量为1.6g,质量分数为16%.
点评 本题考查混合物的计算,题目难度不大,利用差量法简化计算,注意根据质量守恒定律理解质量差量法.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
17.向0.4mol/L 500mL的石灰水中通入SO2气体,得12g白色沉淀,则SO2的体积可能为( )
| A. | 2.24L或4.48L | B. | 2.24L或6.72L | C. | 4.48L或8.96L | D. | 6.72L或8.96L |
18.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 使体积不变,充水蒸气使体系压强增大 | |
| D. | 使压强不变,充氮气使容器体积增大 |
15.不使用其它试剂,区分①CuSO4②NaOH③NaCl④HCl的可能先后顺序是( )
| A. | ①③②④ | B. | ①②③④ | C. | ④①③② | D. | ②①③④ |
2.根据转化关系判断下列说法正确的是( )


| A. | 反应①中(C6H10O5)n可表示淀粉或纤维素 | |
| B. | 反应②属于氧化反应 | |
| C. | 将在空气中灼烧后的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 |
12.工业上利用氢气在氯气中燃烧,将所得产物溶于水制备盐酸.有人设想利用原电池原理直接制备盐酸的同时获取电能,假设这种想法可行,下列说法肯定错误的是( )
| A. | 两极材料都用金属铂,用一定浓度的盐酸做电解质溶液 | |
| B. | 通入氯气的电极为原电池的正极 | |
| C. | 该方法可将化学能完全转化为电能 | |
| D. | 通氢气的电极发生的反应为:H2→2H++2e- |
19.关于下列各图的叙述中正确的是( )


| A. | 甲表示A、B 两物质的溶解度随温度变化情况,将tl℃时A、B 的饱和溶液分别升温至t2℃时(水不减少),溶质的质量分数B>A | |
| B. | 乙表示常温下,稀释HA、HB 两种酸的稀溶液时,溶液pH 随加水量的变化,则NaA 溶液的pH 小于同浓度的NaB 溶液的pH | |
| C. | 丙表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| D. | 丁表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A 对应的状态为化学平衡状 |
16.以下反应不属于“同一价态的同种元素既被氧化又被还原”的是( )
| A. | KClO3与盐酸 | B. | Cl2与NaOH溶液 | C. | Na2O2和CO2 | D. | Na2S2O3与稀硫酸 |
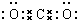 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为 .
.