题目内容
20.9g有机物A完全燃烧,将生成的气体通过浓硫酸,浓硫酸增重9g.剩余气体再通过碱石灰,碱石灰增重17.6g.A蒸气对氢气的相对密度为45.A在酸性高锰酸钾溶液的作用下,最终变成B,核磁共振氢谱显示A中有3种类型氢原子的吸收峰,峰面积之比为2:2:1.(1)求该有机物A的分子式;
(2)写出A的结构简式;
(3)写出A与B形成高分子化合物的反应方程式.
分析 A蒸气对氢气的相对密度为45,则相对分子质量为45×2=90,9g有机物的物质的量为$\frac{9g}{90g/mol}$=0.1moL,将生成的气体通过浓硫酸,浓硫酸增重9g.剩余气体再通过碱石灰,碱石灰增重17.6g,可知n(H2O)=$\frac{9g}{18g/mol}$=0.5mol,n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,则有机物中N(C)=$\frac{0.4}{0.1}$=4,N(H)=$\frac{0.5}{0.1}$×2=10,结合相对分子质量计算O原子个数可确定分子式,结合核磁共振氢谱显示A中有3种类型氢原子的吸收峰,峰面积之比为3:1:1,可确定结构简式,并确定有机物的性质,以此解答该题.
解答 解:(1)A蒸气对氢气的相对密度为45,则相对分子质量为45×2=90,9g有机物的物质的量为$\frac{9g}{90g/mol}$=0.1moL,将生成的气体通过浓硫酸,浓硫酸增重9g.剩余气体再通过碱石灰,碱石灰增重17.6g,可知n(H2O)=$\frac{9g}{18g/mol}$=0.5mol,n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,则有机物中N(C)=$\frac{0.4}{0.1}$=4,N(H)=$\frac{0.5}{0.1}$×2=10,则N(O)=$\frac{90-4×12-10}{16}$=2,则有机物分子式为C4H10O2,
答:有机物A的分子式为C4H10O2;
(2)A在酸性高锰酸钾溶液的作用下,最终变成B,核磁共振氢谱显示A中有3种类型氢原子的吸收峰,峰面积之比为3:2:1:1,则A应为HOCH2CH2CH2CH2OH,B为HOOCCH2CH2COOH,
答:A的结构简式为HOCH2CH2CH2CH2OH;
(3)A为HOCH2CH2CH2CH2OH,B为HOOCCH2CH2COOH,二者发生缩聚反应生成高分子化合物,化学方程式为nHOCH2CH2CH2CH2OH+nHOOCCH2CH2COOH→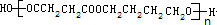 +(2n-1)H2O,
+(2n-1)H2O,
答:与B生成高分子化合物的化学方程式为nHOCH2CH2CH2CH2OH+nHOOCCH2CH2COOH→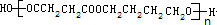 +(2n-1)H2O.
+(2n-1)H2O.
点评 本题考查有机物的推断,为高频考点,侧重考查学生的分析能力、计算能力,关键是计算确定A的分子式,熟练掌握官能团的性质与转化,理解结构和性质的关系,难度中等.

| A. | 25℃时,pH=7的NH4Cl和NH3•H2O的混合溶液中,OH-数为10-7NA | |
| B. | 33.6 L NO2溶于足量的水得到的溶液中含有的NO3-数为NA | |
| C. | P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则1 mol该分子中含有的共价键数目是10NA | |
| D. | 18g的D2O与NA个-CH3具有相同的电子数 |
| A. | 玻璃 | B. | 水泥 | C. | 陶瓷 | D. | 大理石 |
| A. | 相对分子质量之比1:2:3 | B. | 质子数之比2:3:6 | ||
| C. | 电子数之比为6:3:2 | D. | 体积之比6:3:2 |
| A. | 蛋白质和氨基酸 | B. | 淀粉和纤维素 | ||
| C. | 葡萄糖和果糖 | D. | 植物油和动物脂肪 |
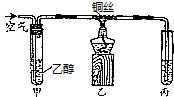
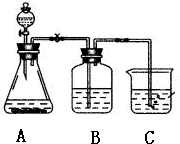 某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验: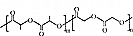 )制成的外科手术缝线在人体内可降解,省去了缝合皮肤后拆线的麻烦,合成PLGA的一种路线如图:
)制成的外科手术缝线在人体内可降解,省去了缝合皮肤后拆线的麻烦,合成PLGA的一种路线如图: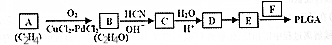
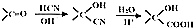
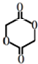 ;
;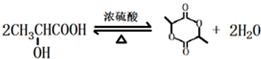 ;
;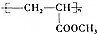 的合成线路:
的合成线路: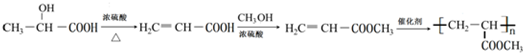 .
.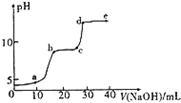 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.