题目内容
11.喀斯特地貌地区蕴藏了大量石灰石.下列材料与石灰石主要成分相同的是( )| A. | 玻璃 | B. | 水泥 | C. | 陶瓷 | D. | 大理石 |
分析 喀斯特地貌地区蕴藏了大量石灰石,石灰石的成分为碳酸钙,据此分析判断.
解答 解:A.玻璃成分为硅酸钠、硅酸钙和二氧化硅的混合物,与石灰石主要成分不相同,故A错误;
B.水泥是硅酸三钙、硅酸二钙和铝酸三爱的混合物,与石灰石主要成分不相同,故B错误;
C.陶瓷成分主要为二氧化硅,故C错误;
D.大理石主要成分为碳酸钙,与石灰石主要成分相同,故D正确;
故选D.
点评 本题考查了无机非金属材料的成分分析判断,主要是玻璃、水泥、陶瓷等物质成分的记忆,注意知识的积累,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
1.下列说法正确的是( )
| A. | 化学变化一定会产生新的核素 | |
| B. | 明矾净水过程涉及化学变化 | |
| C. | 催化剂能改变化学反应的活化能和焓变 | |
| D. | 在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径: 途径a:Fe$\stackrel{H_{2}SO_{4}}{→}$H2$→_{△}^{Cu}$Cu 途径b:CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu 实际操作中,制得等质量的铜时,途径a和途径b消耗Fe的质量一定相等 |
2.甲同学进行Fe2+还原性的实验,针对异常现象进行探究.
步骤一:制取FeCl2溶液.向0.1mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1.
实验二:向1mL FeCl2溶液中滴加2滴0.1mol•L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:2Fe2++H2O2+2H+═2Fe3++2H2O、Fe3++3SCN?Fe(SCN)3.
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀.
Ⅲ.向2mL 0.1mol•L-1 FeCl3溶液中滴加2滴0.1mol•L-1KSCN溶液,变红,通入O2,无明显变化.
①实验I的说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应;
②实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能.
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-.
(3)甲直接用FeCl2•4H2O配制0.15mol•L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去.进一步探究其原因:
Ⅰ.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH,约为3.由此,乙认为红色不褪去的可能原因是H2O2将Fe2+氧化为Fe3+,pH增大促进Fe3+水解形成红色Fe(OH)3胶体.
Ⅱ.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
步骤一:制取FeCl2溶液.向0.1mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1.
实验二:向1mL FeCl2溶液中滴加2滴0.1mol•L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:2Fe2++H2O2+2H+═2Fe3++2H2O、Fe3++3SCN?Fe(SCN)3.
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀.
Ⅲ.向2mL 0.1mol•L-1 FeCl3溶液中滴加2滴0.1mol•L-1KSCN溶液,变红,通入O2,无明显变化.
①实验I的说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应;
②实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能.
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-.
(3)甲直接用FeCl2•4H2O配制0.15mol•L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去.进一步探究其原因:
Ⅰ.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH,约为3.由此,乙认为红色不褪去的可能原因是H2O2将Fe2+氧化为Fe3+,pH增大促进Fe3+水解形成红色Fe(OH)3胶体.
Ⅱ.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | 取2 mL BaCl2溶液,滴加2滴0.1 mol•L-1KSCN溶液和5滴5% H2O2溶液 | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1mol•L-1 FeCl3溶液 | 无明显现象 |
19.组成为C6H4S4的物质有吸收微波的功能,可在军事上用做隐形飞机的涂层.下列关于C6H4S4的说法不正确的是( )
| A. | 该物质为有机物 | B. | 该物质为无机物 | ||
| C. | 该物质由三种元素组成 | D. | 该物质燃烧产物可能含CO2 |
6.下列物质属于纯净物的是( )
| A. | 汽油 | B. | 红酒 | C. | 干冰 | D. | 碘酒 |
16.下列物质中,不能与稀盐酸反应的有( )
| A. | Cu | B. | CaCO3 | C. | Zn | D. | AgNO3 |
14.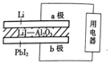 某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2═2LiI+Pb,下列说法正确的是( )
某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2═2LiI+Pb,下列说法正确的是( )
 某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2═2LiI+Pb,下列说法正确的是( )
某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2═2LiI+Pb,下列说法正确的是( )| A. | 电子由b极经用电器流向a极 | |
| B. | I-由a极通过固体电解质传递到b极 | |
| C. | b极上的电极反应式为:PbI2+2e-═Pb+2I- | |
| D. | b极质量减少1.27g时,a极转移的电子数约为6.02×1021 |