题目内容
研究化学反应原理对于生产、生活及环境保护具有重要意义.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=64.39kJ?mol-1
2H2O2(1)═2H2O(1)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
O2(g)═H2O(1)△H=-285.84kJ?mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(2)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
①已知0.4mol KBrO3在反应中得到2mol电子生成X,则X的化学式为 ;该反应的还原剂及其配平后的系数是 .
②根据上述反应可推知 .
a.氧化性:KbrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3c.还原性:AsH3>Xd.还原性:X>AsH3.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=64.39kJ?mol-1
2H2O2(1)═2H2O(1)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
| 1 |
| 2 |
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
(2)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
①已知0.4mol KBrO3在反应中得到2mol电子生成X,则X的化学式为
②根据上述反应可推知
a.氧化性:KbrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3c.还原性:AsH3>Xd.还原性:X>AsH3.
考点:用盖斯定律进行有关反应热的计算,氧化还原反应,氧化性、还原性强弱的比较
专题:
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①根据溴元素化合价的降低情况来计算;化合价升高元素所在的反应物是还原剂;
②物质中元素化合价升高的被氧化,作还原剂,物质中元素化合价降低的被还原,作氧化剂,在同一个氧化还原反应中氧化剂的氧化性最强,还原剂的还原性最强.
(2)①根据溴元素化合价的降低情况来计算;化合价升高元素所在的反应物是还原剂;
②物质中元素化合价升高的被氧化,作还原剂,物质中元素化合价降低的被还原,作氧化剂,在同一个氧化还原反应中氧化剂的氧化性最强,还原剂的还原性最强.
解答:
解:(1)①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=64.39kJ/mol,
②2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ/mol,
③H2(g)+
O2(g)═H2O(l)△H=-285.84kJ/mol,
由盖斯定律①+
②+③得到:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol,
故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol;
(2)①设X中溴元素的化合价为x,则0.4mol(5-x)=2mol,所以x=0,故X为Br2,KBrO3在反应中得到电子,所以KBrO3是氧化剂,AsH3变成了H3AsO4,所以AsH3是还原剂,根据得失电子守恒配平,则还原剂AsH3的系数是5,故答案为:Br2;5AsH3;
②a、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故a正确;
b、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故b错误;
c、AsH3是还原剂,Br2是还原产物,所以还原性AsH3>Br2,故c正确;
d、AsH3是还原剂,Br2是还原产物,所以还原性AsH3>Br2,故d错误.
故选ac.
②2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ/mol,
③H2(g)+
| 1 |
| 2 |
由盖斯定律①+
| 1 |
| 2 |
故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol;
(2)①设X中溴元素的化合价为x,则0.4mol(5-x)=2mol,所以x=0,故X为Br2,KBrO3在反应中得到电子,所以KBrO3是氧化剂,AsH3变成了H3AsO4,所以AsH3是还原剂,根据得失电子守恒配平,则还原剂AsH3的系数是5,故答案为:Br2;5AsH3;
②a、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故a正确;
b、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故b错误;
c、AsH3是还原剂,Br2是还原产物,所以还原性AsH3>Br2,故c正确;
d、AsH3是还原剂,Br2是还原产物,所以还原性AsH3>Br2,故d错误.
故选ac.
点评:本题考查学生盖斯定律及其氧化还原反应中的概念以及电子守恒定律的知识,综合性较强,难度较大.

练习册系列答案
相关题目
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )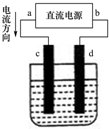

| A、电解过程中,d电极质量增加 |
| B、d为阳极,电极反应为:2Cl--2e-=Cl2↑ |
| C、a为负极、b为正极 |
| D、电解过程中,氯离子浓度不变 |
有关AgCl的沉淀溶解平衡的说法正确的是( )
| A、AgCl难溶于水,溶液中没有Ag+和Cl- |
| B、AgCl沉淀生成和溶解同时在不断进行,且速率相等 |
| C、向AgCl溶液中加入盐酸,一定会有沉淀生成 |
| D、向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
下列条件下,两物质所含分子数不相等的是( )
| A、同温度、相同质量的N2和CO |
| B、常温常压,同体积的H2O和O2 |
| C、同压强、同物质的量的N2和O2 |
| D、同体积、同密度的N2和CO |
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、78g Na2O2与足量CO2充分反应时电子转移数为2NA |
| B、NA个氯气分子的体积为22.4L |
| C、4℃、101kPa时,54mL H2O中含有的分子数为3NA |
| D、1mol/L Na2SO4溶液中离子总数为3NA |
下列关于各图象的解释或结论正确的是( )
A、. 热化学方程式是H2(g)+
| ||
B、. 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | ||
C、 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | ||
D、. 同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者 |
下列离子方程式中,正确的是( )
| A、向AlCl3溶液中滴加过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、CaCO3与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、小苏打治疗胃酸过多:CO32-+2H+=CO2↑+2H2O |
| D、Cu片与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
在指定条件下,下列各组离子可能大量共存的是( )
| A、无色澄清透明溶液中:H+、Cu2+、SO42-、Cl- |
| B、与铝反应放出H2的溶液中:NH4+、K+、NO3-、Br- |
| C、由水电离的c(OH-)=10-13mol?L-1的溶液中:Na+、Cl-、CO32-、NO3- |
| D、滴加酚酞显红色的溶液中:Na+、ClO-、S2-、SO42- |