题目内容
5.类比是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观实际.下列各说法中,正确的是( )| A. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VIIA族元素氢化物沸点顺序也是:HBr>HCl>HF | |
| B. | CH4是正四面体结构,则SiH4也是正四面体结构 | |
| C. | 锂与氧气反应:4Li+O2$\frac{\underline{\;加热\;}}{\;}$2 Li2O,则钠与氧气反应:4Na+O2$\frac{\underline{\;加热\;}}{\;}$2Na2O | |
| D. | CaCO3与稀硝酸反应生成CO2,则CaSO3与稀硝酸反应生成SO2 |
分析 A.IVA族元素氢化物中相对分子质量越大,沸点越大;而VIIA族元素氢化物中HF分子间含氢键,沸点最高;
B.C、Si的最外层电子数均为4,且氢化物中均形成4个单键;
C.钠与氧气加热反应生成过氧化钠;
D.CaSO3与稀硝酸发生氧化还原反应.
解答 解:A.IVA族元素氢化物中相对分子质量越大,沸点越大,则沸点顺序是:GeH4>SiH4>CH4;而VIIA族元素氢化物中HF分子间含氢键,沸点最高,沸点为HF>HBr>HCl,类比不合理,故A错误;
B.C、Si的最外层电子数均为4,且氢化物中均形成4个单键,CH4是正四面体结构,则SiH4也是正四面体结构,类比合理,故B正确;
C.钠比Li活泼,锂与氧气发生4Li+O2$\frac{\underline{\;加热\;}}{\;}$2 Li2O,而钠与氧气发生2Na+O2$\frac{\underline{\;加热\;}}{\;}$Na2O2,类比不合理,故C错误;
D.CaCO3与稀硝酸发生复分解反应生成CO2,CaSO3与稀硝酸发生氧化还原反应生成硫酸钙、NO和水,类比不合理,故D错误;
故选B.
点评 本题考查类比法应用,为高频考点,把握物质的性质、发生的反应、反应规律为解答的关键,侧重分析与应用能力的考查,注意氢键、氧化还原反应的应用,题目难度不大.

练习册系列答案
相关题目
1.已知0.3mol•L-1酒精溶液的密度为ρ1 g•mL-1,0.1mol•L-11酒精溶液的密度为ρ2 g•mL-1,其中ρ1<ρ2,若将上述两溶液等质量混合,所得酒精溶液的物质的量浓度是( )
| A. | 大于0.2mol•L-1 | B. | 等于0.2mol•L-1 | C. | 小于0.2mol•L-1 | D. | 无法估算 |
16.LED灯既能节能、亮度又好.图是某课外活动小组设计的用化学电源使LED灯发光的装置.下列说法正确的是( )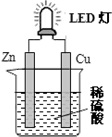

| A. | 锌片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 如果将硫酸换成柠檬汁,导线中就不会有电子流动 | |
| D. | 如果将铜片换成锌片,LED灯仍然会发光 |
10.表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
请按要求回答下列问题:
(1)元素②在周期表中的位置为第二周期第IVA族
(2)④、⑤两种元素相比较,金属性强的是Na(填元素符号);
(3)这些元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(4)元素④和元素⑥形成的化合物的电子式为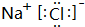 .
.
(5)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式HCl+NH3═NH4Cl.
| ① | ||||||||
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ | ||||||
(1)元素②在周期表中的位置为第二周期第IVA族
(2)④、⑤两种元素相比较,金属性强的是Na(填元素符号);
(3)这些元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(4)元素④和元素⑥形成的化合物的电子式为
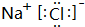 .
.(5)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式HCl+NH3═NH4Cl.
14.苯与乙烯相比较,下列叙述不正确的是( )
| A. | 都能在空气中燃烧 | |
| B. | 都容易发生取代反应 | |
| C. | 苯和乙烯都能在一定条件下发生加成反应 | |
| D. | 苯不能使酸性KMnO4溶液褪色而乙烯能 |
15.如表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | Y氢化物的沸点一定比X氢化物的沸点高 | |
| B. | Z的最高价氧化物的水化物酸性比W的强 | |
| C. | XZ2、XW4 与Na2O的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在TZ2和TW4 |
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置. 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
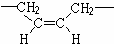 ,若顺丁橡胶的平均相对分子质量为540108,则平均聚合度为10002.
,若顺丁橡胶的平均相对分子质量为540108,则平均聚合度为10002.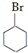 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$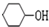 +NaBr.
+NaBr.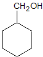 的合成路线.
的合成路线.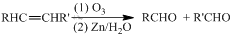 (R,R’代表烃基或氢)CH2=CHCH=CH2$\stackrel{催化剂}{→}$
(R,R’代表烃基或氢)CH2=CHCH=CH2$\stackrel{催化剂}{→}$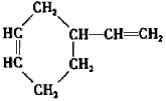

 $→_{催化剂}^{氢气}$
$→_{催化剂}^{氢气}$