题目内容
 TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.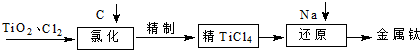
已知:Ⅰ:
Ti(s)+O2(g)=TiO2(s)△H=-946kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
Ti(s)+2Cl2(g)=TiCl4(g)△H=-815kJ?mol-1
Ⅱ:某温度下各物质的沸点如下:
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s)?TiCl4(g)+2CO (g).试计算其反应的△H=
(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用
(3)TiO2与Cl2反应:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)△H=+151kJ?mol-1.该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
(4)还原工序要在惰性气体的气氛中进行的理由是
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,该工艺具有操作简单,成本低,无污染等优点,写出电解制备金属钛时阴极的电极反应式:
考点:制备实验方案的设计,常见化学电源的种类及其工作原理,化学平衡的计算
专题:实验设计题,基本概念与基本理论
分析:(1)根据盖斯定律结合已知热化学方程式计算出目标热化学方程式的焓变;根据化学平衡常数的概念写出反应TiO2(s)+2Cl2(g)+2C(s)?TiCl4(g)+2CO (g)的平衡常数表达式;该反应为放热反应,根据温度对该可逆反应的影响作出TiCl4达到平衡后百分含量随温度的变化趋势图;
(2)根据表中沸点数据可知,TiCl4与FeCl3、SiCl4和AlCl3的沸点相差较大,可以通过蒸馏方法除去杂质;
(3)C能够与氧气反应,根据生成物浓度对化学平衡的影响分析;
(4)根据温度较高时钛、钠能够与空气中氧气反应进行解答;
(5)电解池中阴极发生还原反应,则阴极二氧化钛中钛离子得到电子生成金属钛和氧离子,据此写出电极反应式.
(2)根据表中沸点数据可知,TiCl4与FeCl3、SiCl4和AlCl3的沸点相差较大,可以通过蒸馏方法除去杂质;
(3)C能够与氧气反应,根据生成物浓度对化学平衡的影响分析;
(4)根据温度较高时钛、钠能够与空气中氧气反应进行解答;
(5)电解池中阴极发生还原反应,则阴极二氧化钛中钛离子得到电子生成金属钛和氧离子,据此写出电极反应式.
解答:
解:(1)①Ti(s)+O2(g)=TiO2(s)△H=-946kJ?mol-1
②2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
③Ti(s)+2Cl2(g)=TiCl4(g)△H=-815kJ?mol-1
根据盖斯定律,③+②-①可得:TiO2(s)+2Cl2(g)+2C(s)?TiCl4(g)+2CO (g)△H=-815kJ?mol-1+(-221kJ?mol-1)-(946kJ?mol-1)=-90kJ?mol-1;
反应TiO2(s)+2Cl2(g)+2C(s)?TiCl4(g)+2CO (g)的平衡常数为:K=
;
该反应为放热反应,随着温度的升高,化学平衡向着逆向移动,则平衡常数逐渐减小,则TiCl4达到平衡后百分含量随温度的变化趋势图为: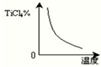 ,
,
故答案为:-90;
; ;
;
(2)粗TiCl4固体加热易气化,由表中数据可知,TiCl4固体与含有的杂质的沸点相差较大,可以通过蒸馏的方法分离,
故答案为:蒸馏(分馏);
(3)反应中TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)加入碳后,碳与氧气反应,导致生成物浓度减小,平衡向着正向移动,
故答案为:降低生成物O2浓度,平衡向正方向移动;
(4)金属钠、钛能够与空气中氧气反应,为了防止高温下Na(Ti)与空气中的O2反应,所以还原工序要在惰性气体的气氛中进行,
故答案为:防止高温下Na(Ti)与空气中的O2作用;
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,电解池中阳极氯离子失去电子生成氯气,阴极TiO2中钛离子得到电子生成金属Ti和O2-,阴极电极反应式为:TiO2+4e-=Ti+2O2-,
故答案为:TiO2+4e-=Ti+2O2-.
②2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
③Ti(s)+2Cl2(g)=TiCl4(g)△H=-815kJ?mol-1
根据盖斯定律,③+②-①可得:TiO2(s)+2Cl2(g)+2C(s)?TiCl4(g)+2CO (g)△H=-815kJ?mol-1+(-221kJ?mol-1)-(946kJ?mol-1)=-90kJ?mol-1;
反应TiO2(s)+2Cl2(g)+2C(s)?TiCl4(g)+2CO (g)的平衡常数为:K=
| c(TiCl4)?c2(CO) |
| c2(Cl2) |
该反应为放热反应,随着温度的升高,化学平衡向着逆向移动,则平衡常数逐渐减小,则TiCl4达到平衡后百分含量随温度的变化趋势图为:
 ,
,故答案为:-90;
| c(TiCl4)?c2(CO) |
| c2(Cl2) |
 ;
;(2)粗TiCl4固体加热易气化,由表中数据可知,TiCl4固体与含有的杂质的沸点相差较大,可以通过蒸馏的方法分离,
故答案为:蒸馏(分馏);
(3)反应中TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)加入碳后,碳与氧气反应,导致生成物浓度减小,平衡向着正向移动,
故答案为:降低生成物O2浓度,平衡向正方向移动;
(4)金属钠、钛能够与空气中氧气反应,为了防止高温下Na(Ti)与空气中的O2反应,所以还原工序要在惰性气体的气氛中进行,
故答案为:防止高温下Na(Ti)与空气中的O2作用;
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,电解池中阳极氯离子失去电子生成氯气,阴极TiO2中钛离子得到电子生成金属Ti和O2-,阴极电极反应式为:TiO2+4e-=Ti+2O2-,
故答案为:TiO2+4e-=Ti+2O2-.
点评:本题通过工业上利用TiO2制备金属钛的流程,考查了物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.

练习册系列答案
相关题目
关于反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4的说法正确的是( )
| A、P既是氧化剂又是还原剂,CuSO4只是还原剂 |
| B、Cu3P既是氧化产物又是还原产物 |
| C、1mol CuSO4可以氧化1/5molP |
| D、若有11molP参加反应,转移电子的物质的量为60mol |
下列有关实验原理、方法和结论都正确的是( )
| A、某无色溶液滴加氯水和CCl4,振荡、静置分层后,下层溶液显紫色,则原溶液中有I- |
| B、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42- |
| D、某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+无K+ |
下列说法正确的是( )
| A、1 molCO2为22.4L |
| B、标准状况下,1mol水体积为22.4L |
| C、相同状况下,1molH2和O2所占体积相同 |
| D、只有在标准状况下气体摩尔体积才是22.4mol/L |
 已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大.A原子、C原子的L电子层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子的外围电子排布式为3d104s1.请填空:
已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大.A原子、C原子的L电子层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子的外围电子排布式为3d104s1.请填空: 利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)