题目内容
将Na2CO3和NaHCO3固体混合物29.6g溶于水,加入1.00mol/L 盐酸600ml,反应完全后可以生成6.72LCO2((标况下).已知盐酸过量,求
(1)原固体混合物中Na2CO3、NaHCO3的物质的量各为多少?
(2)若在上述原溶液中加入1.00mol/L 盐酸400ml,反应完全后,在标准状况下可生成CO2的体积?
(3)若加热此固体混合物,使其充分反应,混合物质量会减轻多少?
(1)原固体混合物中Na2CO3、NaHCO3的物质的量各为多少?
(2)若在上述原溶液中加入1.00mol/L 盐酸400ml,反应完全后,在标准状况下可生成CO2的体积?
(3)若加热此固体混合物,使其充分反应,混合物质量会减轻多少?
考点:有关混合物反应的计算
专题:计算题
分析:(1)设出碳酸钠、碳酸氢钠的物质的量,然后根据总质量、生成二氧化碳的量列式计算出Na2CO3、NaHCO3的物质的量;
(2)先发生反应Na2CO3+HCl=NaHCO3+NaCl,Na2CO3完全转化NaHCO3,再发生NaHCO3+HCl=NaCl+CO2↑+H2O,据此进行计算;
(3)根据差量法计算出充分加热后混合物减轻的质量.
(2)先发生反应Na2CO3+HCl=NaHCO3+NaCl,Na2CO3完全转化NaHCO3,再发生NaHCO3+HCl=NaCl+CO2↑+H2O,据此进行计算;
(3)根据差量法计算出充分加热后混合物减轻的质量.
解答:
解:(1)标况下6.72L二氧化碳的物质的量为:n(CO2)=
=0.3mol,Na2CO3、NaHCO3的物质的量;
设Na2CO3和NaHCO3的物质的量分别为xmol和ymol,
106x+84y=29.6 …①
x+y=0.3 …②
联解①、②得:x=0.2mol、y=0.1mol,
所以原混合物中Na2CO3和NaHCO3的物质的量分别为0.2mol和0.1mol,
答:原混合物中Na2CO3和NaHCO3的物质的量分别为0.2mol和0.1mol;
(2)400mL 1.00mol/L的盐酸中含有氯化氢的物质的量为:n(HCl)=0.40L×1mol/L=0.4mol,则:
Na2CO3 +HCl=NaHCO3 +NaCl
0.2mol 0.2mol 0.2mol
Na2CO3完全转化NaHCO3后,剩余HCl为0.4mol-0.2mol=0.2mol,溶液中NaHCO3总共为:0.1mol+0.2mol=0.3mol,
再发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,0.3molNaHCO3完全反应需要0.3molHCl,大于0.2mol,NaHCO3有剩余,
故生成二氧化碳的物质的量为:n(CO2)=n剩余(HCl)=0.2mol,
标况下0.2mol二氧化碳的体积为:V(CO2)=0.2mol×22.4L/mol=4.48L,
答:完全反应后生成二氧化碳的体积为4.48L;
(3)2NaHCO3=Na2CO3+H2O+CO2↑△m(固体质量减轻)
2mol 62g
0.1mol△m
所以充分加热此混合物固体质量减轻为:△m=
=3.1g,
答:充分加热此混合物固体质量减轻3.1g.
| 6.72L |
| 22.4L/mol |
设Na2CO3和NaHCO3的物质的量分别为xmol和ymol,
106x+84y=29.6 …①
x+y=0.3 …②
联解①、②得:x=0.2mol、y=0.1mol,
所以原混合物中Na2CO3和NaHCO3的物质的量分别为0.2mol和0.1mol,
答:原混合物中Na2CO3和NaHCO3的物质的量分别为0.2mol和0.1mol;
(2)400mL 1.00mol/L的盐酸中含有氯化氢的物质的量为:n(HCl)=0.40L×1mol/L=0.4mol,则:
Na2CO3 +HCl=NaHCO3 +NaCl
0.2mol 0.2mol 0.2mol
Na2CO3完全转化NaHCO3后,剩余HCl为0.4mol-0.2mol=0.2mol,溶液中NaHCO3总共为:0.1mol+0.2mol=0.3mol,
再发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,0.3molNaHCO3完全反应需要0.3molHCl,大于0.2mol,NaHCO3有剩余,
故生成二氧化碳的物质的量为:n(CO2)=n剩余(HCl)=0.2mol,
标况下0.2mol二氧化碳的体积为:V(CO2)=0.2mol×22.4L/mol=4.48L,
答:完全反应后生成二氧化碳的体积为4.48L;
(3)2NaHCO3=Na2CO3+H2O+CO2↑△m(固体质量减轻)
2mol 62g
0.1mol△m
所以充分加热此混合物固体质量减轻为:△m=
| 62g×0.1mol |
| 2mol |
答:充分加热此混合物固体质量减轻3.1g.
点评:本题考查混合物的有关计算,难度中等,注意掌握碳酸钠、碳酸氢钠的化学性质,(2)中明确碳酸钠、碳酸氢钠与盐酸反应时的先后顺序为解答关键,试题有利于提高学生的分析、理解能力及化学计算能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和8体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)( )
| A、乙炔 | B、丙炔 |
| C、2-戊炔 | D、1,3-丁二烯 |
下列说法不正确的是( )
| A、某溶液中加入硝酸银,产生白色沉淀,则溶液中可能含有Cl- |
| B、用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色,则溶液中一定有Na+,可能有K+ |
| C、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味的气体,说明原溶液一定含有CO32- |
| D、可用焰色反应可区分KCl和NaCl |
下列说法正确的是( )
| A、Al(OH)3能与NaOH溶液反应,则Al(OH)3也能与氨水反应 |
| B、过氧化钠能与二氧化碳反应产生氧气,可用作高空飞行或潜水的供氧剂 |
| C、Fe(OH)3溶于氢碘酸的离子方程式为Fe(OH)3+3H+═Fe3++3H2O |
| D、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
 TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.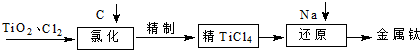
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示.请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示.请回答下列问题: