题目内容
关于反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4的说法正确的是( )
| A、P既是氧化剂又是还原剂,CuSO4只是还原剂 |
| B、Cu3P既是氧化产物又是还原产物 |
| C、1mol CuSO4可以氧化1/5molP |
| D、若有11molP参加反应,转移电子的物质的量为60mol |
考点:氧化还原反应
专题:
分析:11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,P元素的化合价由0降低为-3价,P元素的化合价由0升高为+5价,Cu元素的化合价由+2价降低为+1价,以此来解答.
解答:
解:A.P、Cu元素的化合价降低,则P、CuSO4是氧化剂,P元素的化合价由0升高为+5价,P是还原剂,故A错误;
B.P元素的化合价由0升高为+5价,P是还原剂,H3PO4是氧化产物,Cu3P是还原产物,故B错误;
C.由反应可知,转移30mol电子消耗11molP,15molCuSO4和5molP来一起氧化6molP,其中1mol CuSO4可以氧化
molP,故C正确;
D.由原子守恒可知,11molP参加反应,被氧化的P为6mol,则转移的电子为6mol×5=30mol,故D错误;
故选C.
B.P元素的化合价由0升高为+5价,P是还原剂,H3PO4是氧化产物,Cu3P是还原产物,故B错误;
C.由反应可知,转移30mol电子消耗11molP,15molCuSO4和5molP来一起氧化6molP,其中1mol CuSO4可以氧化
| 1 |
| 5 |
D.由原子守恒可知,11molP参加反应,被氧化的P为6mol,则转移的电子为6mol×5=30mol,故D错误;
故选C.
点评:本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从元素的化合价角度分析,题目难度不大.

练习册系列答案
相关题目
下列关于化学反应限度的说法中正确的是( )
| A、任何一个化学反应都能达到一个化学平衡状态 |
| B、当可逆反应在一定条件下达到最大限度是,正反应速率和逆反应速率相等 |
| C、平衡状态是一种静止的状态 |
| D、化学反应的限度不可能通过改变外界条件而改变 |
反应CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,达到平衡时,在其他条件不变的情况下,下列说法正确的是( )
| A、加入催化剂,反应速率加快,反应的也随之改变 |
| B、升高温度,反应速率加快,反应放出的热量不变 |
| C、改变压强,平衡不发生移动,反应放出的热量不变 |
| D、如果将该反应设计成原电池,反应放出的热量不变 |
下列解释实验事实的离子方程式正确的是( )
| A、用醋酸检验牙膏中的摩擦级碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
| C、酸性KI淀粉溶液久置后变蓝:4l-+O2+4H+=2I2+2H2O |
| D、Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S |
只由KHS、CaSO4、KHSO3、CaSO3四种物质组成的固体粉末中,测知硫元素的质量分数ω(S)=a%,则氧元素的质量分数ω(O)为( )
| A、1-2.25a% |
| B、2.25a% |
| C、1-1.75a% |
| D、全部 |
将agFe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液,使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
| A、0.1 mol.L-1 |
| B、0.2mol.L-1 |
| C、0.4mol.L-1 |
| D、无法计算 |
 离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:
离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:
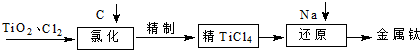
 TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.