题目内容
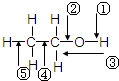 乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明正确的是
乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明正确的是( )
| A、和金属钠作用时,键②断裂 |
| B、和浓硫酸共热至170℃时,键①和⑤断裂 |
| C、和乙酸、浓硫酸共热时,键①断裂 |
| D、在铜催化下和氧气反应时,键①和②断裂 |
考点:乙醇的化学性质
专题:有机物的化学性质及推断
分析:根据乙醇的性质,结合反应物与产物的结构判断.有机反应重在掌握反应的机理即清楚断键与成键位置.
A.乙醇与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键;
B.乙醇发生消去反应,断开的是碳氧键与羟基所连的碳的相邻碳的氢;
C.乙醇与酸发生酯化反应,断开的羟基上的氢氧键.
D.乙醇在铜催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢;
A.乙醇与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键;
B.乙醇发生消去反应,断开的是碳氧键与羟基所连的碳的相邻碳的氢;
C.乙醇与酸发生酯化反应,断开的羟基上的氢氧键.
D.乙醇在铜催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢;
解答:
解:A.乙醇与金属钠反应生成乙醇钠和氢气:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,故乙醇断键的位置为:①,故A错误;
B.乙醇和浓H2SO4共热至170℃时,发生消去反应,生成乙烯,故乙醇断键的位置为:②和⑤,故B错误;
C.乙醇和CH3COOH共热时,生成乙酸乙酯,故乙醇断键的位置为:①,故C正确;
D.乙醇在Ag催化下与O2反应生成乙醛和水,故乙醇断键的位置为①和③,故D错误,
故选C.
B.乙醇和浓H2SO4共热至170℃时,发生消去反应,生成乙烯,故乙醇断键的位置为:②和⑤,故B错误;
C.乙醇和CH3COOH共热时,生成乙酸乙酯,故乙醇断键的位置为:①,故C正确;
D.乙醇在Ag催化下与O2反应生成乙醛和水,故乙醇断键的位置为①和③,故D错误,
故选C.
点评:本题主要考查乙醇的化学性质,掌握反应的机理是解题的关键,难度不大.

练习册系列答案
相关题目
当不慎有大量氯气逸出周围空间时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是( )
| A、NaOH |
| B、NaCl |
| C、醋酸 |
| D、Na2CO3 |
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,利用空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3.下列判断错误的是( )
| A、电池工作时,电子由铝板沿导线流向铂网 |
| B、负极的电极反应式为O2+2H2O+4e-═4OH- |
| C、铂电极做成网状,可增大与氧气的接触面积 |
| D、该电池通常只需要更换铝板就可继续使用 |
下列说法正确的是( )
| A、在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol |
| B、在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为△H=-285.8kJ/mol |
| C、测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D、在稀溶液中:H+(aq)+OH--(aq)═H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
下列物质属于易溶于水的电解质的是( )
| A、NH3 |
| B、Na2SO4 |
| C、Cl2 |
| D、BaSO4 |
下列离子中能在溶液中大量共存的是( )
| A、Na+、K+、OH-、Cl- | ||||
B、Na+、Cu2+、SO
| ||||
C、Ba2+、Na+、SO
| ||||
D、Ba2+、HCO
|
在KClO3+6HCl═KCl+3Cl2↑+3H2O中,被还原的氯元素和被氧化的氯元素的物质的量之比是( )
| A、1:6 | B、1:5 |
| C、5:1 | D、6:1 |