题目内容
请指出表中分子的空间构型,判断其中哪些属于极性分子,哪些属于非极性分子.(填有或无)
| 分子 | 空间构型 | 分子有无极性 | 分子 | 空间构型 | 分子有无极性 |
| O2 | CS2 | ||||
| CO2 | H2O | ||||
| BF3 | NH3 | ||||
| CCl4 | 苯 |
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:对于ABn型分子,通过计算中心原子的价层电子对数确定VSEPR模型,去除所含孤电子对数得分子的空间构型;由极性键构成的分子,由该分子的分子空间结构决定分子极性.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子.若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子.苯用杂化理论解答.
解答:
解:O2是由共价键构成的双原子分子,空间构型为直线形,分子无极性;
CO2中C的价层电子对数=2+
(4-2×2)=2+0=2,VSEPR模型和分子空间构型均为直线型,分子无极性;
H2O中O的价层电子对数=2+
(6-2×1)=2+2=4,VSEPR模型为四面体,去掉2个孤电子对,分子空间构性为V形,分子有极性;
CS2中C的价层电子对数=2+
(4-2×2)=2+0=2,VSEPR模型和分子空间构型均为直线型,分子无极性;
BF3中B的价层电子对数=3+
(3-3×1)=3+0=3,VSEPR模型和分子空间构型均为平面正三角形,分子无极性;
NH3中N的价层电子对数=3+
(5-3×1)=3+1=4,VSEPR模型为四面体,分子空间构型为三角锥形,分子有极性;
CCl4中C的价层电子对数=4+
(4-4×1)=4+0=4,VSEPR模型和分子空间构型均为正四面体形,分子无极性;
苯中碳原子SP2杂化,形成三个呈平面正三角形的轨道,与碳原子、氢原子形成σ键,是平面结构、键角为120°,而每个碳原子均有一个没有杂化的P轨道,肩并肩形成π键,所以苯中有介于单双键之间的特殊键,分子呈平面正六边形,分子无极性;
故答案为:
CO2中C的价层电子对数=2+
| 1 |
| 2 |
H2O中O的价层电子对数=2+
| 1 |
| 2 |
CS2中C的价层电子对数=2+
| 1 |
| 2 |
BF3中B的价层电子对数=3+
| 1 |
| 2 |
NH3中N的价层电子对数=3+
| 1 |
| 2 |
CCl4中C的价层电子对数=4+
| 1 |
| 2 |
苯中碳原子SP2杂化,形成三个呈平面正三角形的轨道,与碳原子、氢原子形成σ键,是平面结构、键角为120°,而每个碳原子均有一个没有杂化的P轨道,肩并肩形成π键,所以苯中有介于单双键之间的特殊键,分子呈平面正六边形,分子无极性;
故答案为:
| 分子 | 空间构型 | 分子有无极性 | 分子 | 空间构型 | 分子有无极性 |
| O2 | 直线形 | 无 | CS2 | 直线形 | 无 |
| CO2 | 直线形 | 无 | H2O | V形 | 有 |
| BF3 | 平面三角形 | 无 | NH3 | 三角锥形 | 有 |
| CCI4 | 正四面体形 | 无 | 苯 | 平面正六边形 | 无 |
点评:对于对于An型分子的空间构型通常应用“价层电子对互斥理论”解释比较简单,对于像乙烯、乙炔、苯等分子的空间构型用“价层电子对互斥理论”不好解释,通常用“杂化轨道理论”解释,两种理论相互补充.

练习册系列答案
相关题目
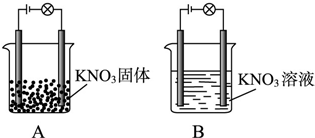 某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是
某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是( )
| A、KNO3不是电解质 |
| B、KNO3溶液是电解质 |
| C、在KNO3溶液中,水电离出了大量的离子 |
| D、在水溶液中KNO3电离出了可以自由移动的离子 |
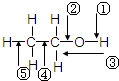 乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明正确的是
乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明正确的是( )
| A、和金属钠作用时,键②断裂 |
| B、和浓硫酸共热至170℃时,键①和⑤断裂 |
| C、和乙酸、浓硫酸共热时,键①断裂 |
| D、在铜催化下和氧气反应时,键①和②断裂 |