题目内容
下列说法正确的是( )
| A、在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol |
| B、在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为△H=-285.8kJ/mol |
| C、测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D、在稀溶液中:H+(aq)+OH--(aq)═H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、燃烧热是C燃烧生成CO2时放出的热量;
B、燃烧热是1mol可燃物完全燃烧释放的热量;
C、中和热测定时,必须测定起始温度和反应最高温度;
D、浓硫酸溶解放热.
B、燃烧热是1mol可燃物完全燃烧释放的热量;
C、中和热测定时,必须测定起始温度和反应最高温度;
D、浓硫酸溶解放热.
解答:
解:A、C的燃烧热是C完全燃烧生成CO2时放出的热量,故A错误;
B、1mol氢气燃烧生成液态水放出的热量是氢气的燃烧热,故B正确;
C、中和热测定时,虽然必须测定起始温度和反应后温度,即反应开始前酸和碱的温度,反应后的最高温度,反应后温度不一定为最高温度,故C错误;
D、浓硫酸溶解时放热,0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ,故D错误.
故选:B.
B、1mol氢气燃烧生成液态水放出的热量是氢气的燃烧热,故B正确;
C、中和热测定时,虽然必须测定起始温度和反应后温度,即反应开始前酸和碱的温度,反应后的最高温度,反应后温度不一定为最高温度,故C错误;
D、浓硫酸溶解时放热,0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ,故D错误.
故选:B.
点评:熟记燃烧热和中和热的概念,知道中和热的测定实验,是解决本题的关键.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
已知某乳制品中富含钙元素,则下列食品中也富含钙元素的是( )
| A、水果 | B、动物肝脏 |
| C、海带 | D、豆类 |
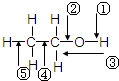 乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明正确的是
乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明正确的是( )
| A、和金属钠作用时,键②断裂 |
| B、和浓硫酸共热至170℃时,键①和⑤断裂 |
| C、和乙酸、浓硫酸共热时,键①断裂 |
| D、在铜催化下和氧气反应时,键①和②断裂 |
3molCl2和2molCO2相比较,下列叙述中正确的是( )
| A、分子数相等 | B、原子数相等 |
| C、体积相等 | D、质量相等 |
下列所示的实验装置中,能达到实验目的是( )
A、 除去Cl2中的HCl |
B、 分离乙醇和乙酸 |
C、 检查装置气密性 |
D、 配制150 mL 0.10 mol?L-1盐酸 |
国际无机化学命名委员会将元素周期表原先的主、副族族号取消,从左往右改为18列第IA族为第1列,0族元素为第18列,按这个规定,下列说法不正确的是( )
| A、原子最外层有2个电子的元素,不一定是第2列元素 |
| B、第3~12列元素全为金属 |
| C、第17列元素的原子,其半径越大,越容易失去电子 |
| D、每列元素的单质,从上到下,熔沸点均依次增大 |
下列溶液中C(Cl-)与50mL 2mol?L-1 MgCl2溶液中C(Cl-)相等的是( )
| A、150 mL 2mol?L-1的NaCl溶液 |
| B、75mL 1mol?L-1的CaCl2溶液 |
| C、200mL 4mol?L-1的KCl溶液 |
| D、50 mL 1mol?L-1的AlCl3溶液 |
 A、B、C、D四种短周期元素,且A、D、B为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图为如图,据此填空:
A、B、C、D四种短周期元素,且A、D、B为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图为如图,据此填空: