题目内容
下列十二种物质中:Fe、CaO、SO3、盐酸、硫酸、KOH溶液、NH4HCO3、CCl4、NH3?H2O、HF、BaSO4、熔融的KCl.其中属于强电解质、弱电解质、非电解质的物质种类依次为( )
| A、5、2、2 |
| B、7、3、2 |
| C、6、2、4 |
| D、5、3、4 |
考点:电解质与非电解质,强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:电解质是指:在水溶液中或熔融状态下能够导电的化合物;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;
单质、混合物既不是电解质也不是非电解质;
在水溶液里或熔融状态下完全电离的电解质是强电解质,部分电离的电解质是弱电解质,强酸、强碱和大部分的盐属于强电解质,弱酸、弱碱、水是弱电解质,弱电解质分步电离;以此解答.
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;
单质、混合物既不是电解质也不是非电解质;
在水溶液里或熔融状态下完全电离的电解质是强电解质,部分电离的电解质是弱电解质,强酸、强碱和大部分的盐属于强电解质,弱酸、弱碱、水是弱电解质,弱电解质分步电离;以此解答.
解答:
解:Fe是单质,既不是电解质也不是非电解质;
CaO是化合物,熔融状态下能够完全电离而导电,属于强电解质;
SO3、本身不能电离,是化合物,属于非电解质;
盐酸是混合物,既不是电解质也不是非电解质;
硫酸是化合物,在水溶液能完全电离而导电,属于强电解;
KOH溶液是混合物,既不是电解质也不是非电解质;
NH4HCO3是化合物,在水溶液能完全电离而导电,属于强电解;
CCl4在水溶液里和熔融状态下都不导电的化合物,属于非电解质;
NH3?H2O在水溶液中能够部分电离而导电,属于弱电解质;
HF在水溶液中能够部分电离而导电,属于弱电解质;
BaSO4是化合物,熔融状态下能够完全电离而导电,属于强电解质;
熔融的KCl是化合物,熔融状态下能够完全电离而导电,属于强电解质;
所以属于强电解质有:CaO、硫酸、NH4HCO3、BaSO4、熔融的KCl;
属于弱电解质:NH3?H2O、HF;
属于非电解质:SO3、CCl4;
故选A.
CaO是化合物,熔融状态下能够完全电离而导电,属于强电解质;
SO3、本身不能电离,是化合物,属于非电解质;
盐酸是混合物,既不是电解质也不是非电解质;
硫酸是化合物,在水溶液能完全电离而导电,属于强电解;
KOH溶液是混合物,既不是电解质也不是非电解质;
NH4HCO3是化合物,在水溶液能完全电离而导电,属于强电解;
CCl4在水溶液里和熔融状态下都不导电的化合物,属于非电解质;
NH3?H2O在水溶液中能够部分电离而导电,属于弱电解质;
HF在水溶液中能够部分电离而导电,属于弱电解质;
BaSO4是化合物,熔融状态下能够完全电离而导电,属于强电解质;
熔融的KCl是化合物,熔融状态下能够完全电离而导电,属于强电解质;
所以属于强电解质有:CaO、硫酸、NH4HCO3、BaSO4、熔融的KCl;
属于弱电解质:NH3?H2O、HF;
属于非电解质:SO3、CCl4;
故选A.
点评:本题考查了电解质与非电解质、强电解质与弱电解质的概念及判断,题目难度不大,注意明确强弱电解质的本质区别,明确电解质与非电解质的概念及判断方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 常温下,取pH=2的HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A、HB的电离方程式为HB═H++B- |
| B、稀释前,c(HB)>c(HA)=0.01mol?L-1 |
| C、NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+) |
| D、NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
有A、B、C、D四种金属.将A与B用导线连接起来,浸入电解质溶液中,B为正极.将A、D分别投入等浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化.如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A、D A B C |
| B、D C A B |
| C、B A D C |
| D、A B C D |
下列有关化学用语正确的是( )
| A、乙醇的结构简式:C2H6O |
| B、Cl-的电子排布式:1s22s22p63s23p6 |
C、硫离子的结构示意图: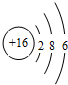 |
| D、氯化钠的分子式:NaCl |
下列叙述中,不正确的是( )
| A、Cl2和SO2分别通入品红试液中,均使品红试液褪色 |
| B、硝酸银溶液通常保存在棕色试剂瓶中 |
| C、常温下,铁和铝与浓硫酸不发生任何反应 |
| D、葡萄糖与新制的Cu(OH)2悬浊液反应,有砖红色物质生成 |
如图所示的变化中,属于化学变化的是( )
A、 石油分馏 |
B、 净化水 |
C、 蒸发食盐水 |
D、 铁丝在氧气中燃烧 |
下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A、NaCl溶液、BaS04 |
| B、铜、二氧化硫 |
| C、NaCl晶体、酒精 |
| D、熔融的KNO3、硫酸溶液 |
在容积不变的密闭容器中,可逆反应:A(g)+2B(g)?3C(g)+D(s)△H<0,达到化学平衡状态的标志是( )
| A、气体密度不再发生变化 |
| B、A、B的物质的量浓度之比等于1:2 |
| C、容器内总压强不再改变 |
| D、单位时间内消耗n mol A,同时消耗2n mol B |