题目内容
在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.3mol/L |
| B、Y2为0.1mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |
考点:化学反应的可逆性
专题:
分析:可逆反应的特点:反应不能进行到底.可逆反应无论进行多长时间,反应物不可能100%地全部转化为生成物;
全部转到一边,求算各物质浓度的取值范围,依此得出正确结论.
全部转到一边,求算各物质浓度的取值范围,依此得出正确结论.
解答:
解:Z全部转化时,X2的物质的量浓度为:0.1+
=0.2 mol?L-1,Y2的物质的量浓度为:0.3+
=0.4mol?L-1,故c(X2)的取值范围为:0<c(X2)<0.2 mol?L-1;当X2全部转化时,Z的物质的量浓度为:0.2+0.1×2=0.4mol?L-1,Y2的物质的量浓度为:0.3-0.1=0.2mol?L-1,故c(Y2)的取值范围为:0.2mol?L-1<c(Y2)<0.4 mol?L-1,c(Z)的取值范围为:0<c(Z)<0.4 mol?L-1;故
A.c(Z)的取值范围为:0<c(Z)<0.4 mol?L-1,故A正确;
B.0.2mol?L-1<c(Y2)<0.4 mol?L-1,故B错误;
C.0<c(X2)<0.2 mol?L-1,故C错误;
D.0<c(Z)<0.4 mol?L-1,故D错误,
故选A.
| 0.2 |
| 2 |
| 0.2 |
| 2 |
A.c(Z)的取值范围为:0<c(Z)<0.4 mol?L-1,故A正确;
B.0.2mol?L-1<c(Y2)<0.4 mol?L-1,故B错误;
C.0<c(X2)<0.2 mol?L-1,故C错误;
D.0<c(Z)<0.4 mol?L-1,故D错误,
故选A.
点评:本题考查可逆反应的特点,难度不大.要注意对于可逆反应,反应物不可能100%地全部转化为生成物.

练习册系列答案
相关题目
室温时,M(OH)2(s)?M2+(aq)+2OH-(aq).Ksp[M(OH)2]=a,c(M2+)=bmol?L-1时,溶液的pH等于( )
A、
| ||||
B、
| ||||
C、14+
| ||||
D、14+
|
一定条件下水分解生成氢气和氧气,有关物质和能量的转化关系如图所示,下列判断正确的是( )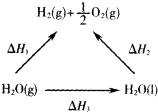

| A、△H1>△H2 |
| B、△H2<△H3 |
| C、△H1=△H2+△H3 |
| D、△H1+△H3>△H2 |
下列说法中正确的是( )
| A、放热反应在常温下都能自发进行 |
| B、Fe3++3H2O?Fe(OH)3+3H+是吸热反应 |
| C、熵值大小关系为:S(冰)>S(水)>S(水蒸气) |
| D、对C(s)+H2O(g)?CO(g)+H2(g),多加些炭可以提高化学反应速率 |
下列离子方程式正确的是( )
| A、钠和水的反应:Na+H2O=Na++OH-+H2↑ |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| D、氢氧化钡溶液跟稀硫酸反应:Ba2++OH-+H++SO42-=BaSO↓+H2O |
短周期元素X、Y、Z在元素周期表中的相对位置所示,其中X原子最外层电子数是次外层电子数的3倍.下列说法错误的是( )
| X | |
| Y | Z |
| A、元素X和元素Y的最高正化合价相同 |
| B、气态氢化物的热稳定性:H2Y<H2X |
| C、Y2Z2是共价化合物 |
| D、酸性:HZO4>H2YO4 |
 高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂.
高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂.