题目内容
一定条件下水分解生成氢气和氧气,有关物质和能量的转化关系如图所示,下列判断正确的是( )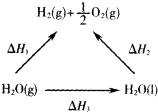

| A、△H1>△H2 |
| B、△H2<△H3 |
| C、△H1=△H2+△H3 |
| D、△H1+△H3>△H2 |
考点:反应热的大小比较
专题:
分析:根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等).
图中:以水蒸气为起点,最终到达氢气和氧气,两条途径能量相同;
图中:以水蒸气为起点,最终到达氢气和氧气,两条途径能量相同;
解答:
解:由盖斯定律可知,以水蒸气为起点,最终到达氢气和氧气,两条途径能量相同,即△H1=△H2+△H3,其中△H1>0,△H2>0,△H3<0,所以△H1>△H2,△H2>△H3,△H1+△H3<△H2,故选AC.
点评:本题考查了盖斯定律的应用,题目难度不大,注意把握盖斯定律的含义,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
铁是人类应用较早,当前应用量最大的金属元素.下列有关铁及其化合物的有关说法中正确的是( )
| A、Fe3+与KSCN产生血红色沉淀 |
| B、赤铁矿的主要成分是Fe3O4 |
| C、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 |
| D、铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
 某温度下,相同pH值的氨水和氢氧化钠溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的氨水和氢氧化钠溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A、Ⅱ为氨水稀释时的pH值变化曲线 |
| B、a、b、c三点溶液的导电性:c>b=a |
| C、a、b、c三点溶液中水的电离程度:c=b>a |
| D、用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc |
25℃时,0.01mol/L的稀盐酸溶液中水电离出的H+的浓度是( )
| A、5×10-13mol/L |
| B、0.01 mol/L |
| C、1×10-7 mol/L |
| D、1×10-12mol/L |
在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.3mol/L |
| B、Y2为0.1mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |
已知25℃、101kPa条件下:3O2(g)=2O3(g)△H=+284.2kJ?mol-1下列说法正确的是( )
| A、等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B、等质量的O2比O3能量高,由O2变O3为放热反应 |
| C、O3比O2稳定,由O2变O3为吸热反应 |
| D、O2比O3稳定,由O2变O3为放热反应 |
下列化合物中,既含有离子键又含有共价键的是( )
| A、HBr |
| B、CO2 |
| C、CaCl2 |
| D、NaOH |
 是一种新型可生物降解的高分子材料,主要用于制造可降解纤维,可降解塑料和医用材料.它以淀粉为原料,先水解为葡萄糖,再在乳酸菌的作用下降葡萄糖转变为乳酸
是一种新型可生物降解的高分子材料,主要用于制造可降解纤维,可降解塑料和医用材料.它以淀粉为原料,先水解为葡萄糖,再在乳酸菌的作用下降葡萄糖转变为乳酸 ,乳酸在催化剂的催化下聚合成聚乳酸.聚乳酸材料废弃后,先水解成乳酸,乳酸在微生物的作用下分解为CO2和H2O.请用化学方程式表示上述聚合与降解的过程.
,乳酸在催化剂的催化下聚合成聚乳酸.聚乳酸材料废弃后,先水解成乳酸,乳酸在微生物的作用下分解为CO2和H2O.请用化学方程式表示上述聚合与降解的过程.